أولاً: رسم تركيب لويس لجزئ الميثان CH4
- لمراجعة خطوات رسم تركيب لويس لأى جزئ يمكن الرجوع إلى هذا الرابط: قواعد رسم تراكيب لويس
(1) فى الجزئ CH4 الذي يحتوى على ذرة (C) واحدة ، وأربع ذرات (H) ولأن جاذبية (C) للألكترونات قليلة لذلك يكون هو الذرة المركزية.
(2) نوجد العدد الكلي لإلكترونات التكافؤ.
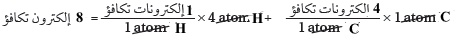
(3) حدد العدد الكلي لأزواج الربط.
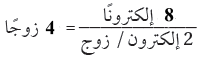
(4) استخدم أزواج الربط الأربعة لربط أربع ذرات (H) مع ذرة (C) المركزية.
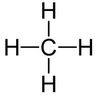
(5) حدد عدد الأزواج غير الرابطة.
4 زوجاً (المجموع الكلي) – 4 أزواج مستخدمة = 0 زوجاً غير رابط
(6) نرسم تركيب لويس للميثان

ثانياً: رسم تركيب لويس لجزئ الإيثان C2H6
(1) فى الجزئ C2H6 الذي يحتوى على ذرتين (C) ، وست ذرات (H) وتكون هنا ذرتي الكربون هما الذرتين المركزيتين.
(2) نوجد العدد الكلي لإلكترونات التكافؤ.
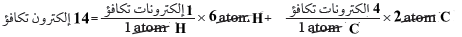
(3) حدد العدد الكلي لأزواج الربط.
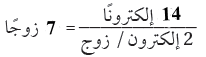
(4) استخدم أزواج الربط لربط ست ذرات (H) مع ذرتين (C) المركزية.

(5) حدد عدد الأزواج غير الرابطة.
7 زوجاً (المجموع الكلي) – 7 أزواج مستخدمة = 0 زوجاً غير رابط
(6) نرسم تركيب لويس للإيثان
