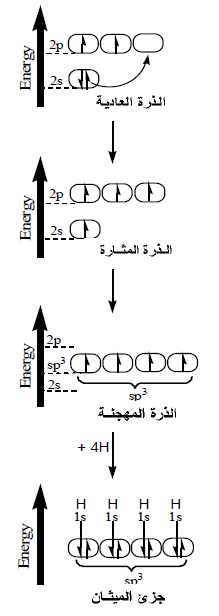
الأشكال الآتية توضح كيفية حدوث التهجين بين المستويات 2s , 2p
نأخد مثال ذرة الكربون ويكون التوزيع الألكتروني لها:
C6: 1s2, 2s2 2p2
أولاً: تهجين من النوع sp3
- من التوزيع الإلكتروني لذرة الكربون نجد أنها تحتوى على مزدوج إلكتروني في الفلك الفرعي (2s) وإلكترونين مفردين في الفلك الفرعي (2p).
- عند إثارة الذرة ينتقل إلكترون من الفلك الفرعي (2s) إلى الفلك الفرعي (2p) فتمتلك بذلك ذرة الكربون 4 افلاك نصف ممتلئة ولكنها غير متماثلة في الشكل والطاقة.
- يحدث تهجين بين أفلاك (2s) وأفلاك (2p) في مستوى طاقة اعلى من مستوى طاقة الفلك (2s) وأقل من مستوى طاقة الفلك (2p) فتتكون 4 أفلاك متماثلة في الشكل والطاقة.
- تسمى الأفلاك المهجنة بأفلاك (sp3) لأنها نتجت من تهجين فلك (s) مع ثلاثة أفلاك (p)
- مثال: جزئ الميثان
ثانياً: تهجين من النوع sp2
- يتم تهجين فلك (2s) مع فلكين (2p) في ذرة الكربون المثارة فتنتج 3 أفلاك متماثلة في الشكل والطاقة ويبقى الفلك (pz) في وضعه الأصلي قبل التهجين وتسمى الأفلاك المهجنة sp2 لأنها تكونت من تهجين فلك (s) وفلكين (p).
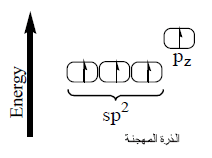
- يحدث تنافر بين الأفلاك المهجنة حتى تصل الزوايا بينها إلى 120o
- مثال: جزئ الإيثلين
ثالثاً: تهجين من النوع sp
- يتم تهجين فلك (2s) مع فلك (2p) في ذرة الكربون المثارة فتنتج فلكين متماثلين في الشكل والطاقة ويبقى الفلك (py) والفلك (pz) في وضعهما الأصلي قبل التهجين.
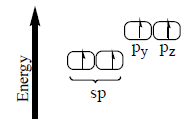
- تسمى الأفلاك المهجنة sp لأنها تكونت من تهجين فلك (s) وفلك (p).
- يحدث تنافر بين الأفلاك المهجنة حتى تصل الزوايا بينها إلى 180o
- مثال: جزئ الأسيتيلين
أنواع التهجين بين المدارين s , p
