طرق التعبير عن تركيز المحاليل
(1) طريقة النسبة المئوية % ( V/V -W/W - W/V )
النسبة المئوية الوزنية W/W : عدد جرامات المذاب في 100 مللتر من المحلول
مثال : محلول مائي تركيزه مثلاً 2% وزناً؛ هذا يعني أن كتلة المذاب 2 جرام في 100 مللتر من المحلول . يمكن تعيين النسبة المئوية بالوزن للمادة المذابة B في وزن معين من المذيب A كالآتي :
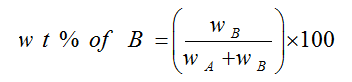
النسبة المئوية الحجمية V/V : هي عبارة عن حجم المذاب في 100 مللتر من المحلول
مثال : محلول مائي تركيزه مثلاً 3% حجماً؛ هذا يعني أن حجم المذاب يساوي 3 مللتر مذابة في 100 مللتر من المحلول ، يمكن تعيين النسبة المئوية بالحجم للمادة المذابة B كما يلي :
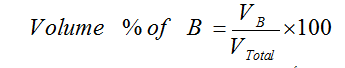
(2) المولارية Molarity
هي عدد مولات المذاب في 1000 مللتر من المحلول.
- المولارية = عدد مولات المادة المذابة/1000 مللتر من المحلول
- ويمكن حساب عدد مولات المذاب بالقانون التالي:
عدد المولات = وزن المادة المذابة بالجرام/الوزن الجزيئي للمادة المذابة .

(3) العيارية Normality
ويرمز لها بالرمز N وهي عبارة عن عدد الجرامات المكافئة من المادة المذابة في لتر من المحلول .

(4) المولالية Molality
هي عبارة عن نسبة عدد مولات المذاب إلى 1000 جرام من المذيب. المولالية = عدد مولات المذاب/ 1000جم من المذيب، وعدد المولات تُحسب بنفس الطريقة السابقة .

(5) الكسر المولي Mole fraction
ويُرمز له بالرمز X . ويعرف الكسر المولي X لأي مكونة في المحلول بأنه عدد مولات تلك المكونة مقسوماً على عدد المولات الكلية لجميع مكونات المحلول . إذا اقترضنا أن nA مول من مذاب A ، وأن nB مول من مذاب B قد أذيبت في nC مول من المذيب C فإن الكسر المولي لكل من هذه المكونات الثلاث يُعبر عنه كما يلي :
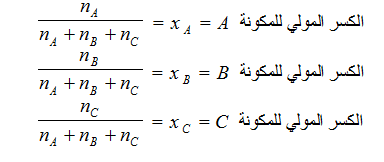
يلاحظ أن مجموع الكسور المولية للمكونات يساوي الوحدة
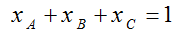
(6) حساب التركيز بـ ppm
- ppm : تعنى جزء لكل مليون جزء أى part per million
- ppm : هو كتلة المذاب بالميللجرام المذابة في 1 لتر من المذيب.
- ppm = mg/L
- الصيغة الرياضية للقانون:
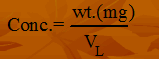
(7) حساب التركيز بـــ ppb
- ppb : تعنى جزء لكل بليون جزء أى part per billion
- ppb : هو كتلة المذاب بالميكروجرام المذابة في 1 لتر من المذيب.
- ppb = μg /L
- الصيغة الرياضية للقانون:
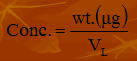
كما يمكنك قراءة الموضوعات الآتية الخاصة بتركيزات المواد الكيميائية من موقع تعرف على علم الكيمياء:
(1) العيارية Normality + مسائل محلولة
(2) المولارية Molarity + مسائل محلولة
(3) الكسر المولي Mole Fraction + مسائل محلولة
(4) قانون التخفيف للمحاليل Dilution of solution + قوة المحلول (Strength (S + مسائل محلولة
(5) النسبة المئوية الوزنية للمذاب Weight Percentage + مسائل محلولة
(6) طرق التعبير عن تركيز المحاليل methods expressing concentrations