أولاً: حساب عدد المولات لكربونات الصوديوم
الكتلة المولية Na2CO3 لكربونات الصوديوم = 23*2 + 12+ 3*16 = 106 جرام
1mol of Na2CO3 → 106g
mol of Na2CO3 → 0.212g ؟؟
عدد مولات كربونات الصوديوم= 0.002 مول
ثانياً: حساب التركيز بالمولارية
المولارية = عدد المولات / الحجم باللتر
الحجم باللتر = 100/1000 = 0.1
M = 0.002 / 0.1
M = 0.02 molar
ثالثاً: حساب وزن 10 مل من تركيز كربونات الصوديوم
Wt = M * molecular wt * VL
10/1000 * W10ml = 0.02 * 106
W10ml = 0.0212 gm
رابعاً: حساب التركيز بـ ppm
- ppm : تعنى جزء لكل مليون جزء أى part per million
- ppm : هو كتلة المذاب بالميللجرام المذابة في 1 لتر من المذيب.
- ppm = mg/L
- الصيغة الرياضية للقانون:
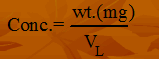
- الوزن بالمللى جرام = 0.0212 جم * 1000 = 21.2 مللى جرام.
- الحجم باللتر = 100/1000 = 0.1 لتر
Concentration by ppm = 21.2/0.1 = 212 ppm