اليوريا Urea
- تعتبر اليوريا من أهم أنواع الأميدات
- تسمى اليوريا أيضاً كرباميد Carbamide
- هي بلورات صلبة عديمة اللون والرائحة.
- الصيغة البنائية لها :
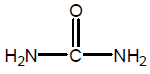
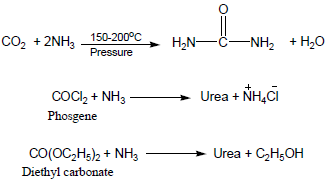
- تصنع بتفاعل الأمونيا مع ثاني أكسيد الكربون مع التسخين والضغط .
- تستخدم كسماد للأراضي الزراعية وفي صناعة بعض الأدوية وتدخل في صناعة بعض أنواع اللدائن.
- نجح العالم فردش فولر عام 1828م فى تخليق اليوريا صناعياً وسماها (البول الصناعي).
- وقد كان ذلك إجهاضاً لنظرية القوة الحيوية التى كانت تنص على لزوم إنتاج كل المواد العضوية في الخلايا الحية واستحالة إنتاجها معملياً.
- تم تحضير اليوريا بتسخين مركب سيانات الأمونيوم (مادة غير عضوية).
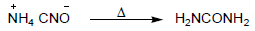
- تحضر اليوريا بالطرق الآتية أيضاً:
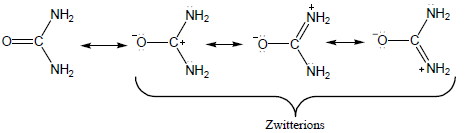
يعرف التركيب الذي يحتوي على كل من الشحنة الموجبة والسالبة على نفس الجزئ بالأيونات الأمفوتيرية أو أيونات زويتر Zwitterions
استخدامات اليوريا في الصناعة
(1) هو تصنيع الميلانين الذي يستخدم في صناعة أنواع متعددة من الراتنج ، وبعض هذا الراتنج يستخدم في صناعة الأخشاب الرقائقية.
(2) تستخدم في تحضير راتنج يوريا-فورمالدهيد.
(3) تستخدم اليوريا غالبا في تصنيع الأسمدة الأزوتية.
(4) تستخدم اليوريا كمادة اختزال .
ذوبانية اليوريا فى الماء
- يذوب اليوريا فى الماء بسهولة Highly soluble in water نتيجة للروابط الهيدروجينة الكثيفة التى تكونها مع الماء كما بالشكل التالي:
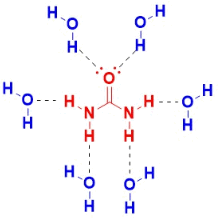
- تذوب اليوريا فى الماء تحت الظروف التالية:
1079g/L at 20 °C
1670g/L at 40 °C
2510g/L at 60 °C
4000g/L at 80 °C
- تذوب اليوريا فى المواد الأخري تحت الظروف التالية:
500g/L in glycerol
50g/L in ethanol
4g/L in acetonitrile