قواعد رسم تركيب لويس للأيونات المتعددة الذرات
(1) توقع موقع ذرات معينة.
- تكون الذرة التي لها أقل جذب للإلكترونات المشتركة هي الذرة المركزية في الجزيء. ويكون هذا العنصر أقرب إلى الجهة اليسرى من الجدول الدوري.
- وفي الغالب يكون مكان الذرة المركزية فى مركز الجزئ، كما أنه يحيط بها أكبر عدد من الذرات في الجزئ. وعليه فإن باقي الذرات في الجزئ هي ذرات جانبية.
- يكون الهيدروجين دائماُ ذرة جانبية؛ لأنه يشارك بإلكترون واحد من الإلكترونات، ويتصل بذرة واحدة فقط.
(2) حدد عدد الإلكترونات المتوافرة لتكوين روابط
- ولإيجاد العدد الكلي لإلكترونات التكافؤ نجد أولاً العدد المتوافر لدى الذرات الموجودة في الأيون، ثم نطرح شحنة الأيون إن كان موجباً أو نجمع شحنته أن كان سالباً.
(3) حدد عدد أزواج إلكترونات الربط
ولتحديد هذا العدد اقسم عدد الإلكترونات المتوافرة للربط على (2)
(4) حدد أماكن أزواج الربط.
ضع زوج ترابط واحدًا (رابطة واحدة) بين الذرة المركزية وكل ذرة جانبية.
(5) حدد عدد أزواج إلكترونات الترابط المتبقية
- لتحديد ذلك اطرح عدد الأزواج المستخدمة فى الخطوة الرابعة من العدد الكلي للأزواج في الخطوة الثالثة.
- حيث تبين الأزواج المتبقية عدد الأزواج غير المترابطة والأزواج المستخدمة في الروابط الثنائية والثلاثية.
- ثم ضع الأزواج غير المترابطة حول كل ذرة جانبية (ماعدا الهيدروجين) مرتبطة مع الذرة المركزية لتحقق القاعدة الثمانية
- ثم ضع أى أزواج إضافية على الذرة المركزية.
(6) حدد ما إذا كانت الذرة المركزية تحقق القاعدة الثمانية.
- هل الذرة المركزية محاطة بإربعة أزواج من الألكترونات؟ إذا كان الجواب لا فأنها لا تحقق القاعدة الثمانية.
- لتحقيق القاعدة الثمانية حول زوجاُ أو زوجين من الأزواج غير المترابطة في الذرات الجانبية إلى رابطة ثنائية أو ثلاثية بين الذرة الجانبية والذرة المركزية، فتبقى هذه الأزواج مرتبطة مع الذرة الجانبية، وكذلك مع الذرة المركزية.
- تذكّر أن الكربون والنيتروجين والأكسجين والكبريت عادة ما تكوّن روابط ثنائية وثلاثية.
رسم تركيب لويس لأيون الأمونيوم +NH4
(1) أيون الأمونيوم يحتوي على ذرة نيتروجين واحدة وأربع ذرات هيدروجين وشحنة موجبة واحدة (+1).
ذرة النيتروجين هي الذرة المركزية، وذرات الهيدروجين الأربع هي الذرات الجانبية.
(2) أوجد العدد الكلي لإلكترونات التكافؤ المتوافرة للترابط
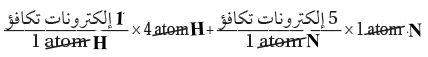
- (1) ألكترون من الشحنة الموجبة = 8 إلكترون تكافؤ
(3) حدد العدد الكلي لأزواج الترابط

(4) ارسم رابطة أحادية بين ذرة النيتروجين (N) المركزية وذرات الهيدروجين (H) الجانبية.
(5) اطرح عدد الأزواج المستخدمة من العدد الكلي لأزواج الألكترونات المتوفرة.
4 أزواج (المجموع الكلي) – 4 أزواج مستخدمة = صفر زوجاً غير رابطاً
(6) تبين عملية طرح الأزواج غير المرتبطة المستخدمة من الأزواج المتوافرة عدم وجود إلكترونات متوافرة لذرة النيتروجين
يبين الشكل التالي تركيب لويس لأيون الأمونيوم الموجب.
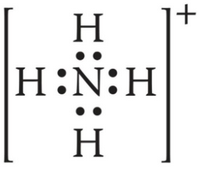
حققت ذرة النيتروجين حالة الثمانية إلكترونات، والشحنة الكلية للمجموعة هي +1
ويمكن كتابتها أيضاُ على الصورة:
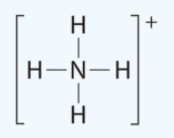
أو الصورة الآتية:

السهم يشير إلى الرابطة التناسقية حيث تمنح ذرة النيتروجين إلكترونين إلى ذرة الهيدروجين المستقبلة.