طاقة التأين Ionization Energy
- طاقة التأين هي أدني طاقة تكفي لانتزاع إلكترون من الذرة في وضعها المستقر وحالتها الغازية.
- أو هى مقدار الطاقة بالكيلوجول اللازمة لنزع مول واحد من الألكترونات من مول واحد من الذرات الغازية.
- وحدة قياس طاقة التأين kJ/mol
- وقد خصصت الذرات الغازية فى هذا التعريف لأنه من المفترض أن الذرة في الطور الغازي لا تتأثر بمجاوراتها ولذلك فلا وجود للقوى بين الجزيئية (أى قوى ما بين الجزيئات intermolecular forces) لتؤخذ فى الحسبان عند قياس طاقة التأين.
- إن مقدار طاقة التأين هو مقياس لشدة تمسك الذرة بالإلكترون فكلما ازدادت طاقة التأين أصبحت إزالة الإلكترون أكثر صعوبة.
- طاقة التأين الأولى (I1) هو مقدار الطاقة اللازمة لإزالة الإلكترون الأول في حالة الذرة كثيرة الإلكترونات
- توضح المعادلات التالية طاقة التأين الأولى والثانية والثالثة للعنصر (X)

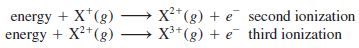
وتتواصل إزالة الإلكترونات الآتية على هذا النحو.
- ينخفض التنافر بين الإلكترونات الباقية عند إزالة إلكترون من ذرة ما نظراً لبقاء الشحنة النووية ثابتة فإنه يلزم طاقة أكثر لإزالة إلكترون آخر من الأيون موجب الشحنة لذلك فإن طاقات التأين تتزايد وفقاً للترتيب الآتي:
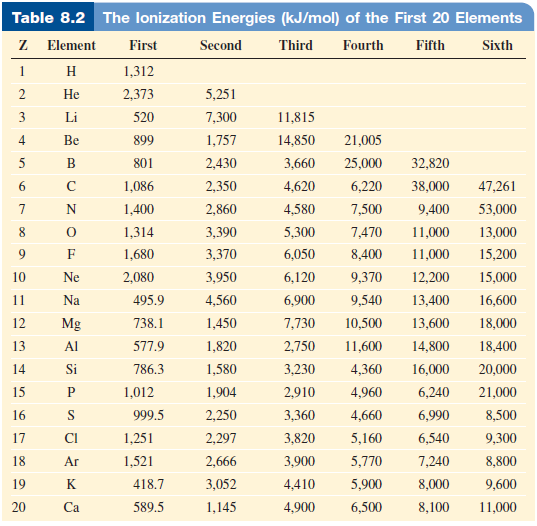
- يبين الجدول التالي طاقات التأين الأول 20 عنصراً
- عملية التأين هي دائماً ماصة للحرارة endothermic وقد اصطلح على أن تكون الطاقة الممتصة من قبل الذرات (أو الأيونات) في أثناء عملية التأين موجبة، وهكذ فإن طاقات التأين جميعها مقادير موجبة.
- يوضح الشكل التالي تغير طاقة التأين الأولى مع العدد الذري
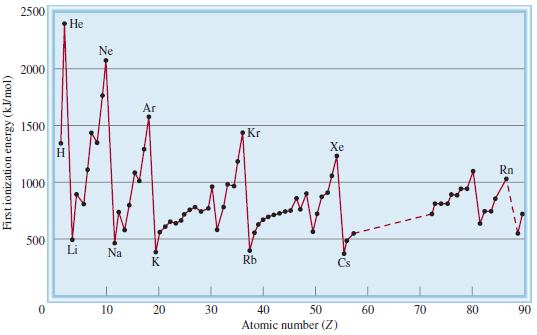
تدرج طاقة التأين فى الدورات
- أن طاقات التأين الأولى لعناصر الدورة تزداد بزيادة العدد الذري.
- إن سبب هذا المنحنى هو ازدياد الشحنة النووية الفعالة effective nuclear charge من اليسار إلى اليمين لأن شحنة نووية فعالة أكبر تعنى تمسكاً أشد بالألكترون الخارجي ومن ثم طاقة تأين أولى أعلى.
- أن طاقات التأين المرتفعة للغازات النبيلة والمشتقة من البناءات الإلكترونية لحالاتها لأكثر استقراراً تفسر حقيقة أن معظم هذة العناصر غير نشطة كيميائياً .
- الهيليوم (1S1) هو أعلى طاقة تأين أولى من بين العناصر جميعها.
تدرج طاقة التأين فى المجموعات
- تتناقص طاقة التأين مع زيادة العدد الذري في المجموعة الواحدة (أى كلما انتقلنا إلى أسفل المجموعة).
- لعناصر المجموعة الواحدة توزيعات إلكترونية خارجية مشابهة لكن مع ازدياد عدد الكم الرئيسي (n) فان متوسط بعد إلكترونات التكافؤ يزداد كذلك.
- أن ازدياد التباعد بين الألكترون والنواة يعني تجاذباً أضعف ما يزيد من سهولة إزالة الإلكترون الأول كلما أنتقلنا من عنصر إلى آخر أسفل منه فى المجموعة. لذلك تزداد الخاصية المعدنية للعناصر من أعلى إلى أسفل. يتضح هذا التوجة على نحو الخصوص فى عناصر المجموعات 3A وصولاً إلى 7A. نجد على سبيل المثال فى المجموعة 4A أن الكربون ليس معدناً وأن السليكون والجرمانيوم أشباة معادن أما القصدير والرصاص فهما من المعادن.
- توجد عناصر المجموعة (1A) وهي المعادن القلوية في أسفل المنحنى البيانى فى الشكل السابق وهى تمتلك أقل طاقات تأين أولى . يمتلك كل منها إلكترون تكافؤ واحداً (التوزيع الإلكتروني الخارجي هو ns1) وهو محجوب بشكل فعال بواسطة المستويات الداخلية الممتلئة لذلك فأن من السهل من حيث الطاقة إزالة إلكترون من ذرة المعدن القلوي لتكوين أحادي الشحنة الموجبة (+Li+ , Na+ , K , .....)
- نلاحظ أن أيونات المجموعة (1A) هي أيونات إيزوالكترونية isoelectronic (أى لها نفس التوزيع الإلكتروني) مع الغازات النبيلة التى تتقدمها مباشرة فى الجدول الدوري.
- إن طاقات التأين الأولى لعناصر المجموعة 2A (المعادن القلوية الترابية) أعلى منها للمعادن القلوية حيث تمتلك المعادن القلوية الترابية إلأكترونين من إلكترونات التكافؤ ( التوزيع الإلكتروني الخارجي هو ns2) ولأن هذين الإلكترونين لا يحجبان بعضهما جيداً ، فإن الشحنة النووية الفعالة لذرة المعدن القلوي التربي اكبر منها لمعدن القلوى الذي يتقدمه.
- طاقات التأين للمعادن منخفضة نسبياً كما فى الشكل السابق مقارنة باللافلزات وتقع طاقات تأين أشباة المعادن عموماً بين الاثنين، وتشير الاختلافات في طاقة التأين إلى السبب في أن المعادن تكون دائماً كاتيونات في حين تكون اللامعادن أنيونات في المركبات الأيونية.
حالات عدم انتظام التدرج فى طاقات التأين لعناصر الجدول الدوري
(1) يقع أول الاستثناءات بين عناصر المجموعة 2A , 3A فى الدورة نفسها مثلاً بين (B , Be) وبين (Al , Mg)
- لعناصر المجموعة 3A طاقات تأين أولى أقل من عناصر المجموعة 2A
السبب : لأن جميع عناصر المجموعة 3A تمتلك إلكتروناً منفرداً فى مستوى p الفرعي الخارجي (ns2 np1) الذي هو محجوب بشكل جيد عن طريق الألكترونات الداخلية وإلكترونات ns2 لذلك فالطاقة اللازمة لإزالو إلكترون p المفرد هي أقل منها لإزالة إلكترون (s) مزدوج من مستوى الطاقة الرئيسي نفسه.
(2) يقع عدم الانتظام الثاني بين المجموعة 5A , 6A مثلاً بين (N , O) وبين (S , P)
- طاقات التأين لعناصر المجموعة 6A أقل منها لعناصر المجموعة 5A للدورة الواحدة.
- السبب: توجد إلكترونات (P) لعناصر المجموعة 5A ذات التوزيع الألكتروني (ns2 np3) في ثلاث أفلاك مستقلة بحسب قاعدة هوند ويجب على الإلكترون الإضافي للمجموعة 6A ذات التوزيع الألكتروني (ns2 np4) أن يزدوج مع واحد من إلكترونات (P) الثلاثة يؤدي وجود إلكترونين في الفلك نفسه إلى زيادة التنافر ما يجعل تأين ذرة عنصر المجموعة 6A أكثر سهولة على الرغم من ازدياد الشحنة النووية بوحدة واحدة. لذلك فأن طاقات التأين لعناصر المجموعة 6A أقل منها لعناصر المجموعة 5A للدورة الواحدة.