أولاً/ المستوى الفرعي 6p أعلى طاقة من المستوى الفرعي 2p
- يمكن معرفة مستويات الطاقة الفرعية الأقل والأعلى فى الطاقة من خلال تطبيق قاعدة ( n+l)
- تنص قاعدة ( n+l) على أن طاقة الأغلفة الثانوية تزداد كلما ازدادت قيمة ( n+l) وإذا تساوت قيمة (n+l) لغلافين ثانويين أو أكثر فأقلها طاقة ما له اقل قيمة عددية لعدد الكم الرئيسي (n).
حيث (n) : عدد الكم الرئيسي ، (l) : عدد الكم الثانوي
- يمكنك استخدام الجدول التالي فى معرفة قيمة n , l
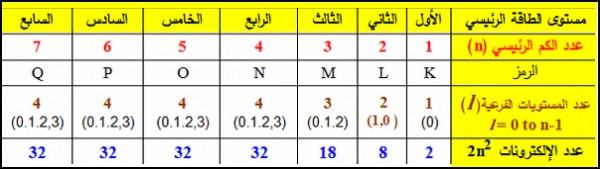
ويكون عدد الكم الثانوي (l) للأغلفة s,p,d,f كالتالي:

أيهما أكثر طاقة 2p أو 6P؟
- يتضح من خلال استخدام القاعدة (n+l)
2p = 2 + 1 = 3
6p = 6 + 1 = 7
وبما أن القيمة أكبر فى حالة 6p عنها فى حالة 2p فأن 6p أعلى فى الطاقة من 2p
أو بتعبير آخر الغلاف 2p يتقدم الغلاف 6p في سلسلة الأغلفة الثانوية أعلاه ويمتلئ بالألكترونات أولاً.
ثانياً/ عدد العقد المدارية
ثانياً/ الأختلاف في عدد العقد المدارية Orbital nodes
- العقدة المدارية هى النقطة أو المستوى الموجودة فى الأوربيتال التي تكون فيها الكثافة الإلكترونية تساوي صفر.
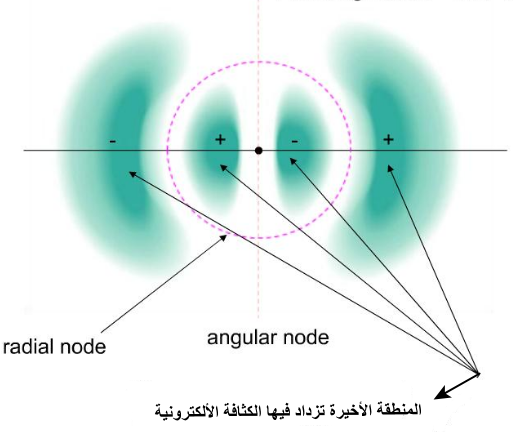
- يوجد نوعين من العقد الزاوية Angular nodes والعقد الشعاعية Radial nodes (قد تكون الترجمة باللغة العربية غير صحيحة)
- العقد الزاوية Angular nodes تكون على هيئة مستوى مسطح flat plane (بزوايا ثابتة) وتكون الكثافة الإلكترونية على طول المستوى تساوي صفر.
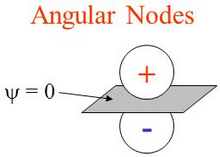
- العقد الشعاعية Radial nodes هي مجالات spheres (عند نصف قطر ثابت) تكون فيها الكثافة الألكترونية = صفر، وتحدث مع زيادة عدد الكم الرئيسي.
- الشكل يوضح العقد الشعاعية فى الأوربتالات (s):
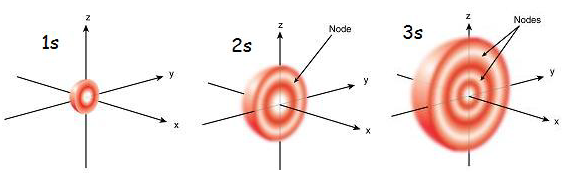
- عدد العقد الشعاعية = n - l - 1 حيث عدد الكم الثانوي (l) وعدد الكم الرئيسى (n).
- العقد الكلية للمدار هي مجموع العقد الزاويّة والعقد الشعاعية وتُعطى مباشرة من العلاقة (n-1)
- ملخص للقوانين السابقة:
angular Nodes = l
Radial Nodes = n - 1 - l
Total Nodes = n-1
- الشكل التالي يوضح العقد الزاوية والعقد الشعاعية والمناطق التى تزداد فيها الكثافة الألكترونية
حدد عدد العقد الموجودة فى الأوربتالات التالية: 2p , 6p
أولاً: للأوربتال 2p
- يكون عدد الكم الرئيسى (n) يساوي (2) ، عدد الكم الثانوي (l) يساوي = 1 (لأنه أوربتال p).
- العدد الكلي للعقد = n-1 لذلك فان العدد الكلي للعقد = 1-2 = 1
- عدد العقد الزاوية يحددها عدد الكم الثانوي (l) وهو يساوي = 1 لذلك عدد العقد الزاوية = 1
- عدد العقد الشعاعية = عدد العقد الكلية - عدد العقد الزاوية = 1-1 = صفر
ثانياً: للأوربتال 6p
- يكون عدد الكم الرئيسى (n) يساوي (6) ، عدد الكم الثانوي (l) يساوي = 1 (لأنه أوربتال p).
- العدد الكلي للعقد = n-1 لذلك فان العدد الكلي للعقد = 1-6 = 5
- عدد العقد الزاوية يحددها عدد الكم الثانوي (l) وهو يساوي = 1 لذلك عدد العقد الزاوية = 1
- عدد العقد الشعاعية = عدد العقد الكلية - عدد العقد الزاوية = 5-1 = 4
نستنتج من القيم أعلاه أن عدد العقد الكلي فى حالة المستوى الفرعي 6p أكثر من عددها فى المستوى الفرعي 2p وهذا يعنى وجود مناطق أكثر تنعدم فيها الكثافة الألكترونية.