تعتمد جميع تفاعلات التعادل في المحاليل المائية على اتحاد أيونات الهيدروجين مع أيونات الهيدروكسيل لتكوين الماء الذي يتأين بدوره إلى أيونات الهيدروجين والهيدروكسيل على النحو التالي:
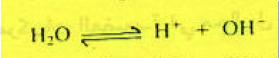
وبتطبيق قانون فعل الكتلة فإن ثابت التأين والذي يرمز له بــ K يعطى بالعلاقة:
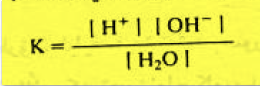
حيث :
K = 1.8 × 10-16 at 25 Co
وحيث أن تركيز الماء فى المحاليل المخففة كبير جداً بالنسبة لتركيز المذيبات الأخرى ، لذا يمكن اعتبار أن تركيز الماء ثابتاً ومساوياً لتركيزه في الماء المقطر أي 1000/18 ويساوي 55.5 مول/لتر ولا يتغير هذا التركيز بصورة ملحوظة إلا فى التراكيز المرتفعة. ويمكن دمج تركيز الماء الثابت في ثابت التأين فتصبح العلاقة:
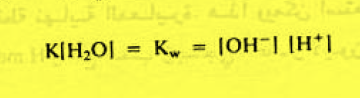
ويسمى الثابت Kw ثابت الحاصل الأيوني للماء وتساوي قيمة عند 25 Co :
Kw = 1.8 × 10-16 × 55.5 = 1 × 10-14
بأخذ log- للطرفين للمعادلة قبل الأخيرة :
[-log Kw = - log [H+] . [OH -
[-log 1 × 10-14 = - log [H+] - log [OH -
14 = [-log [H+] - log [OH -
وبما أن p = - log

لذلك فأن pH محصورة بين 0 و 14 لأن :
pH = 14 - pOH