تفاعل أملاح الهاليدات مع حمض الكبريتيك المركز
- الهاليدات -F-, Cl- , Br- , I هى عوامل مختزلة حيث تزداد القوة كعامل مختزل كلما أتجهنا من أعلى إلى أسفل فى المجموعة.
- قوة الهاليدات كعوامل مختزلة Reducing agents هي التى تشرح الطريقة التى تتفاعل بها مع حمض الكبريتيك المركز.
- حيث يؤكسد حمض الكبريتيك البروميد إلى بروم واليوديد إلى اليود لكنه غير قادر على أكسدة الكلوريد إلى كلور وذلك لأن أيونات اليوديد والبروميد عوامل مختزلة قوية على عكس ايون الكلوريد والفلوريد فهى عوامل مختزلة ضعيفة.
- تزداد قدرة الهاليدات على الأختزال كلما اتجها من أعلى إلى أسفل فى المجموعة السابعة وذلك لأن العامل المختزل له القدرة على التبرع بالألكترونات حيث أنه كلما ازداد حجم الأيون كلما قلت قدرة النواة على جذب الألكترونات الخارجية ويسهل فقدها.
- وعلى ذلك تترتب قوة العوامل المختزلة كالتالي:
-Cl- < Br- < I
- لا يظهر -F أى خواص اختزالية ( لا يعمل كعامل مختزل) نظراً لصغر حجم ذرة الفلور وزيادة ارتبط النواة بالإلكترونات فيصعب فقدها ولا تتبرع بالألكترونات.
- -I- , Br عوامل مختزلة قوية ولكن -Cl عامل مختزل ضعيف.
لماذا لا يؤكسد حمض الكبريتيك الكلوريد إلى كلور ؟
حمض الكبريتيك ليس له القدرة الكافية كعامل مؤكسد ليؤكسد الكلوريد إلى كلور وفي نفس الوقت أيونات الكلور عامل مختزل ضعيف .
- لا يحدث تفاعل اكسدة وأختزال فى هذة الحالة ولكن تفاعل حمض - قاعدة (تفاعل تعادل) وتتصاعد أبخرة بيضاء من حمض الهيدروكلوريك.
↑(NaCl(s) + H2SO4 (l) → NaHSO4 (s) + HCl(g
لماذا يؤكسد حمض الكبريتيك البروميد إلى البروم؟
- أيون البروميد عامل مختزل قوي وأقوى من أيون الكلوريد والفلوريد.
- بعدما يتكون تفاعل التعادل (تفاعل حمض - قاعدة) فأن أيون البروميد يعمل على أختزال حمض الكبريتيك (الذي يعمل كعامل مؤكسد) ويحول عدد تأكسد الكبريت فى حمض الكبريتيك من +6 إلى +4 فى غاز SO2
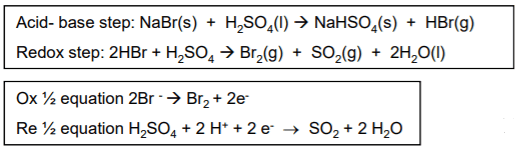
- وحسب المعادلات تتصاعد المواد التالية:
- أبخرة بيضاء من HBr
- أبخرة حمراء من البروم
- غاز عديم اللون حمضى SO2
- لاحظ أن حمض الكبريتيك فى التفاعل الأول يلعب دور الحمض وفى التفاعل الثاني يلعب دور العامل المؤكسد.
لماذا يؤكسد حمض الكبريتيك اليوديد إلى اليود؟
- أيون اليوديد هو عامل مختزل قوى وأقوى أنواع الهاليدات فى القوة الأختزالية.
- بعدما يتكون تفاعل التعادل (تفاعل حمض - قاعدة) فأن أيون اليوديد يعمل على أختزال حمض الكبريتيك (الذي يعمل كعامل مؤكسد) ويحول عدد تأكسد الكبريت فى حمض الكبريتيك من +6 إلى:
(+4) فى غاز SO2
(0) فى حالة الكبريت (S)
(2-) فى حالة كبريتيد الهيدروجين
يتوقف ذلك على كمية حمض اليوديك HI كما هو موضح بالتفاعلات التالية:

- حسب المعادلات تنتج المواد التالية:
- أبخرة بيضاء من غاز HI
- أبخرة بنفسجية من اليود I2
- أبخرة عديمة اللون من ثاني أكسيد الكبريت الحمضي SO2
- تصاعد غاز H2S الذي له رائحة البيض الفاسد
- تكون راسب أصفر من الكبريت
- لاحظ أن حمض الكبريتيك فى التفاعل الأول يلعب دور الحمض وفى التفاعلات الثلاث الأخرى يلعب دور العامل المؤكسد.
- يمكن استخدام جميع الخواص السابقة للكشف على ايونات الهاليدات باستخدام حمض الكبريتيك
المجموعة التحليلية لحمض الكبريتيك المركز للكشف عن الشقوق الحامضية
- تشمل هذة المجموعة الكشف عن الأنيونات الآتية:
الكلوريد -Cl - البروميد -Br - اليوديد -I - النيترات -NO3
يعتمد الكشف على أن حمض الكبريتيك المركز أكثر ثباتاُ من الأحماض التى تشتق منها هذة الأيونات.
- فعند إضافة حمض الكبريتيك المركز لأملاح هذة الأنيونات ثم التسخين تنفصل هذة الأحماض فى صورة غازية يمكن الكشف عنها بالكواشف المناسبة
- التجربة الأساسية : الملح الصلب + حمض الكبريتيك المركز ثم التسخين إذا لازم الأمر
