المول The Mole
- تعـريف المول : هي الكمـيـة التـي تـحـتـوي على عـد افـوجـادرو من الذرات أو الجـزيـئـات أو الأيونات او أي وحدة أخرى .
عدد أفوجادرو NA يساوي: 1023 × 6.02
توضیح: نظراً لانه يصـعـب حـسـاب الوزن الذري لذرة واحـدة وذلك لصـغـرها طبـعـاً، لذلك سوف نضخم الكمية حتى يمكن أن نتعامل معها وذلك بأخذ مـول من الذرات أو الجزيئات أي عدد أفوجادرو من الذرات أو الجزيئات . فـمـثـلأ الدرزن (dozen) بحـتـوي على إثني عشرشيئاً (objects) ، كذلك المول يحتوي على 1023 × 6.02 شيئاً.
One dozen = 12 objects
One Mol = 6.02 x 1023 objects
أمثلة:
- مـول واحـد من جـزيـئـات الأكسجين (O) يـحـتـوي على 1023 × 6.02 من جـزيــات الأكسجين (O2) .
- مول واحد من ذرات الأكسجين (O) يحتوي على 1023 × 6.02 من ذرات الأكسجين
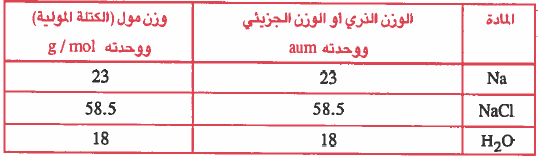
- وقـد وجـد عـمـلـيـاً أن وزن المول بـالـجـرامـات يسـاوي الوزن الذري من الذرات ويسـاوي الوزن الجزيئي من المركبات عددياً.
ولتوضيح ذلك انظر للأمثلة التالية في الجدول التالي :
القوانين المستخدمة لحساب عدد المولات
يمكن حساب عدد المولات من القوانين التالية:

حيث أن:
n = عدد المولات ووحدته ( mol)
m = الوزن بالجرام ووحدته ( g )
NA = عدد افوجادرو ووحدته ( molecule ) او ( ion ) ( atom)
N = عدد الجزيئات أو عدد الذرات أو عدد الأيونات. ووحدته ( Molecule ) او ( ion ) أو ( atom)
M = وزن مول من الذرات ويساوي عددياً الوزن الذري أو وزن مول من الجزيئات ويساوي عددياً الوزن الجزيئي .
مسائل محلولة لحساب عدد المولات
مثال (1): ما عدد مولات NaHCO3 في عينة وزنها 420g ؟
الأوزان الذرية : 23 = H = 1 , C = 12 , O = 16 , Na
الحل:
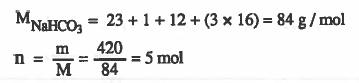
مثال (2): احـسـب عدد مـولات ( 1500molecules) من سـكـر الـسـكـروز. C12H22O11
الحل :
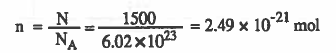
مثال (3): ما وزن (0.2mol) من الكافائين ( C8H10N4O2).
الأوزان الذرية ، O = 16 , H =1 , C = 12 , N = 14
الحل :
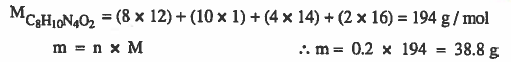
مثال (4): احسب وزن ( molecules 30.1 × 1022 ) من الكحول الميثيلي CH3OH
الأوزان الذرية : 12 = O= 16 , H =1 , C
الحل:
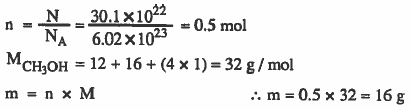
مثال (5): أحسب وزن ذرة كلور علما بأن الوزن الذري للكلور 35.453؟
الحل :
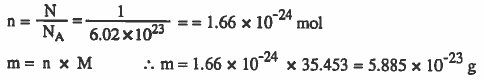
مثال (6): احسب عدد جزيئات 1.2mol من أكسيد السيليكون (SiO2) .
الحل:
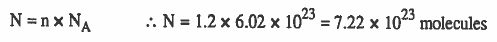
مثال (7): كم عدد جزيئات (18g) من سكر الجلوكوز ( C6H12O6 ) ؟
الأوزان الذرية : 12 = O = 16 , H = 1 , C
الحل :
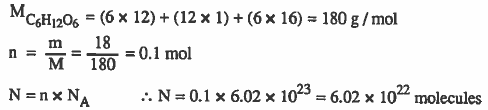
المصادر: كتاب تبسيط الكيمياء العامة - الجزء الأول - الطبعة الأولى 2005/2006 - إعداد الدكتور/ سعيد عبدالله بالبيد