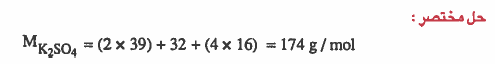المولارية Molarity
تعريف المولارية (C)
- هي عدد المولات (الجزيئات الحجمية) من المذاب في لتر من المحلول .
- يرمز له فى بعض الكتب بالرمز (M).
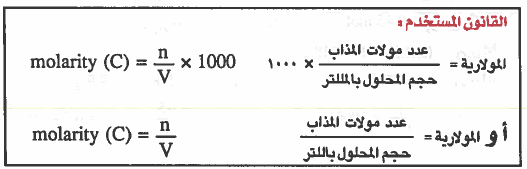
القانون الرياضي لحساب المولارية
يمكن استخدام القانون التالي لحساب المولارية:
ملاحظات هامة
1L = 1dm3 , 1mL = 1cm3
1L = 1000 mL = 1000 cm3
- التركيز بالمولارية = C = molarity
- وزن المذاب ( كتلة المذاب ) = m1
- وزن المذيب ( كتلة المذيب ) = m2
- وزن المحلول ( كتلة المحلول ) = msol
- حجم المحلول = Vsol
- عدد مولات المذاب = n1
- عدد مولات المذيب = n2
- الوزن الجزيئي = M ويساوي وزن المول.
- للمعلومية : مذاب ( Solute ) ، مذیب (Solvent) ، محلول (Solution)
- وحدة التركيز بالمولارية: مولار = mol /dm3 = mol / L = molar
- عند التحويل من وإلى المولارية فإننا نحتاج للكثافة للتحول من الكتلة إلى الحجم العكس
مسائل محلولة
مثال (1): ماذا نعني عندما نقول أن تركيز حمض الكبريت 0.2M؟
الحل :
- نعني أن كل ( 0.2mol ) من حمض الكبريت مذاب في ( 1000mL ) من المحلول.
- أو نعني أن كل ( 0.2mol ) من حمض الكبريت مذاب في ( 1000cm3 ) من المحلول.
- أو نعني أن كل ( 0.2mol ) من حمض الكبريت مذاب في 1L من المحلول.
- أو نعني أن كل ( 0.2mol ) من حمض الكبريت مذاب في 1dm³ من المحلول.
مثال (2): ما مولارية محلول يحتوي على 3mol من سكر الجلوكوز C6H12O6 مذاب في كمية من الماء بحيث يصبح حجم المحلول 750ml ؟
الحل:
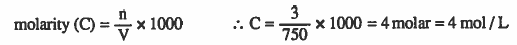
مـثـال (3): محلول مـائـي حـجـمـه 200cm3 يـحـتـوي على 2g من هـيـدروكسيد الصوديوم NaOH. احسب المولارية لهذا المحلول
الأوزان الذرية : 23 = H = 1 & O = 16 & Na
الحل :
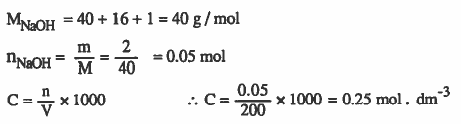
مثال (4):احسب التركيز بالمولارية (mol / L) لمحلول يـحـتـوي على 20g من سكر القصب C12H22O11 مـذاب في 125g من الماء علمـاً أن كـثـافـة المحلول 1.02g/ml
الأوزان الذرية : 12 =O = 16 & H = 1 & C
الحل :
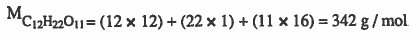
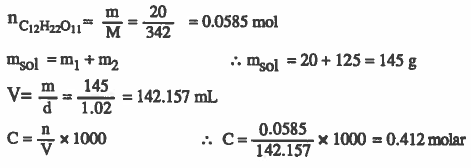
مثال (5): كم تكون كتلة برمنجنات البوتاسـيـوم لـلازمـة لتحضير 300ml من محلول برمنجنات البوتاسيوم KMnO4 الذي مولاريته 0.35molar ؟
الأوزان الذرية : 16 = K = 39 , Mn = 55 , O
الحل :
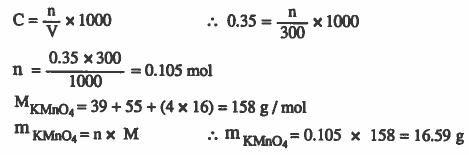
مثال (6): احـسـب مـولارية محلول حمض الكبريتيك الذي كـثـافـتـه 1.2g/mL ويحتوي على % 30 بالوزن من حمض الكبريتيك H2SO4
علماً بأن الأوزان الذرية: H =1 , O = 16 , S = 32
الحل :


مـثـال (7): احـسـب الـتـركـيـز بالمولارية لمحلول تركـيـزه 0.2molal من حـمـض النيتريك علماً بأن كثافته المحلول 1.2g/cm3 .
الأوزان الذرية : 14 = O = 16 , H = 1 , N
الحل :

مثـال (8): أحسب التركيز بالمولارية لمحلول حمض الكلور HCl كثافته 1.4g/mL والكسر المولي لكلوريد الهيدروجين (HCl ) هو 0.3
الأوزان الذرية : 35.5 = H =1 , O = 16 , C1
الحل:

مثـال (9): احسب النسبة المئوية الوزنية لمحلـول كـبـريـتـات البوتاسيوم K2SO4 تركيزه 0.2M وكثافته 1.1g/cm3
الأوزان الذرية : 39 = H =1 , O = 16 , S = 32 , K
الحل: