التخفيف Diluting
- من الأعمال الروتينية التي يكثر عملها في المختبرات عملية التخفيف، ويتم خلالها إضافة المزيد من المذيب حـتى نحصل على محلول أقل تـركـيـزاً ، ولو لاحظنـا مـا حـدث لوجـدنا أن المحلول الجديد يقل فيه التركيز ويزداد الحجم.
- وحيث أن كمية المذاب لم تتغير قبل التخفيف وبعده ، فهذا يعني أيضاً أن عدد المولات لم يتغير ايضاً .
عدد المولات قبل التخفيف = عدد المولات بعد التخفيف
وحيث أن عدد المولات يساوي حاصل ضرب التركيز في الحجم باللتر ( n = C x V ) فأن:
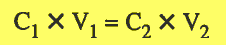
وهو القانون المستخدم فى حل مسائل التخفيف حيث:
C1 = تركيز المحلول بالمولارية قبل التخفيف C2 = تركيز المحلول بالمولارية بعد التخفيف
V1 = حجم المحلول قبل التخفيف ، V2 = حجم المحلول قبل التخفيف
- ملاحظة: يمكن استخدام أي وحدة حجم ولكن يجب أن تكون موحدة قبل وبعد التخفيف.
مسائل محلولة على قانون التخفيف
مثال (1): عنـد تخفيف 250ml من حـمـض الكلور المركز الذي تركيزه 11M إلى حجم قدره 500mL . فكم يكون التركيز بالمولارية للمحلول النهائي ؟
الحل :

مـثـال (2): 50mL من مـحـلـول مـعين تـركـيـزه 0.2M اضـيـف إلـيـه كـمـيـة من الماء حجمها 20mL احسب المولارية للمحلول الجديد.
الحل:

مثال (3): إذا كان لدينا 250mL من محلول تركيزه 1.25M فكم حجم الماء الذي يلزم إضافته لتكوين محلول ترکیزه 0.5M .
الحل :

مثـال (4): احسب حـجـم ووزن هيدروكسيد الصـوديـوم (NaOH) المركـز الـذي تركيزه % 80 وزناً وكـثـافـتـه 1.42g / mL الذي يلزم لـتـحـضير 200mL من المحلول الذي يبلغ ترکیزه 8M
الأوزان الذرية : 23 = H = 1 & O = 16 & Na
الحل:

مـثـال (5): 0.5L من HClO4 الذي تـركـيـزه 2.5M أضـيـف إليـه 0.8L من HCIO4 الذي تركيزه 3.7M ، وخـفـف المحلول حـتـى أصـبـح حـجـمـه 6.31L ، مـا مـولارية المحلول الناتج.
الحل :
