الشحنة الأسمية Formal Charge
- يمكن إيجاد الشحنة الأسمية لذرة ما باستخدام القانون التالي:

حيث أن:
a = عدد الإلكترونات الخارجية (مجال التكافؤ) للذرة. وتساوي رقم المجموعة.
d = عدد الإلكترونات المفردة (الحرة) حول الذرة.
1/2c = نصف عدد الإلكترونات الداخلة في تكوين الروابط للذرة (عدد الروابط)
وللتسهيل يمكن استخدام القانون التالي:

تنبيه: لا يمكن معرفة الشحنة الاسمية للذرة إلا بعد كتابة تركيب لويس بشكل صحيح
أمثلة محلولة على الشحنة الأسمية
مثال (1): وضح الشحنة الأسمية على كل ذرة للجزيء NH3
الأعداد الذرية: 7 = H = 1 , N
الحل:
نجد أن تركيب لويس هو :
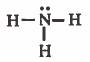
المجموعة (1A) :
1H: 1sl
المجموعة (5A)
7N : 1s2 2s2 2p3
توجد الشحنة الأسمية لكل ذرة باستخدام القانون التالي:
الشحنة الأسمية للذرة = رقم المجموعة - عدد الإلكترونات الحرة - عدد الروابط
( Zero ) = (5) - (2) - ( 6 ) = (N)
H)1 = (1) - (0) - ( 2 ) = Zero)
H)2 = (1) - (0) - ( 2 ) = Zero)
H)3 = (1) - (0) - ( 2 ) = Zero)
لتصبح كما يلي:
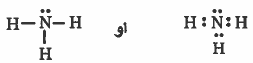
ملاحظة : جميع الذرات شحنتها صفر لذلك لم تكتب شيئاً (شحنة) على الذرات.
مثال (2): وضح الشحنة الأسمية على كل ذرة في جزيء SO2
الأعداد الذربة: 16 = O =8 , S
الحل:
نجد أن تركيب لويس كالتالي:
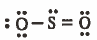
نوجد الشحنة الأسمية لكل ذرة باستخدام القانون في المثال السابق:
1+ = (6) - (2) - (6) = (S)
0 = (4) - (4) - (6) = 1(O)
1- = (2) - (6) - (6) = 2(O)
لتصبح كما يلي :
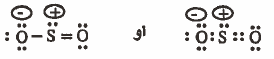
ملاحظة : الذرات التي لم يكتب عليها أي شحنة، شحنتها صفر .
ملاحظات هامة
- الشحنة الأسمية المقصود منها مقارنة عدد الإلكترونات للذرة قبل وبعد الارتباط فمثلاً بالنسبة للمثال السابق:
(أ) ذرة الكبريت قبل التفاعل (في الحالة المستقرة) تمتلك 6 إلكترونات في مجال التكافؤ.
وبعد التفاعل أصبح لديها 5 إلكترونات أي أنها فقدت إلكترون ولهذا نضع عليها شحنة موجبة.
(ب) بالنسبة لذرة الأكسجين ( التي على اليسار) قبل التفاعل (في الحالة المستقرة) تمتلك (6) إلكترونات في مجال التكافؤ. وبعد التفاعل أصبح لديها 7 إلكترونات أي أنها اكتسبت إلكترون ولهذا نضع عليها شحنة سالبة.
(جـ) بالنسبة لذرة الأكسجين (التي على اليمين) قبل التفاعل (في الحالة المستقرة) تمتلك (6) إلكترونات في مجال التكافؤ . وبعد التفاعل أصبح لديها 6 إلكترونات أي أنها لم تفقد أو تكتسب ، لذلك لا يوضع عليها شحنة.
مثال (3): ارسم شکل لويس لكل مما يلي ، ثم وضح الشحنة الاسمية على كل ذرة:
-CH4 , BrO3- , H2O, HNNN , OPCl3 , SiO3-- , CN
CH2O , NO+ , HNO3 , HNO2 , NO2 , C2H4 , N2H4
الحل:
سوف يتم حل هذا السؤال بصورة مختصرة
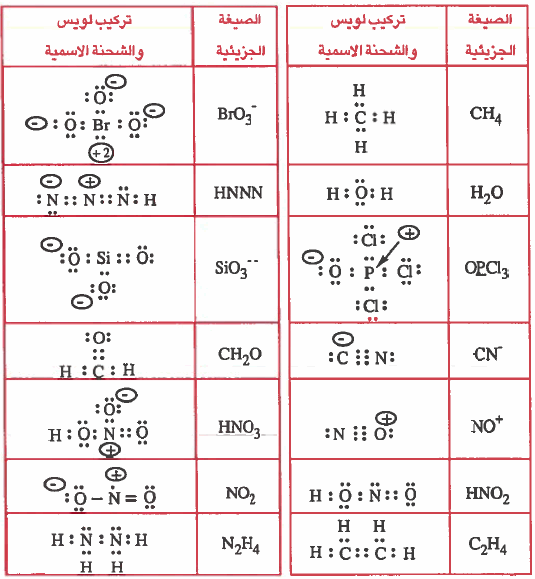
ملاحظة : لمعرفة الأعداد الذرية انظر للجدول الدوري
مثال (4): ارسم شكل لويس لكل مما يلي ثم وضح الشحنة الأسمية على كل ذرة
SF5+ , SF4 , I3- , ICl4- , XeF2
الحل:
ملاحظة: لمعرفة الأعداد الذرية انظر للجدول الدوري
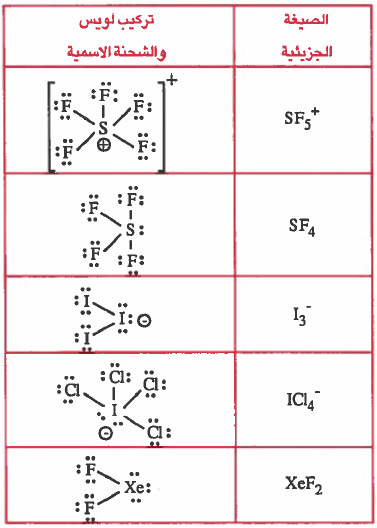
بیدو أنك لاحظت أن جميع الجزيئات أو الأيونات السابقة لا تنطبق عليها القاعدة الثمانية. وبالتالي يتم حلها بالطريقة الأولى فقط.