+BF3 & GaI3 & BI3 & SO3 & CO3-- & NO3- & CH3
مثال (1): ثالث فلوريد البورون BF3
- تركيب لويس:

نلاحظ ان حـول الذرة المركزية ثلاثة ازواج إلكترونية رابطة ، وبذلك تتوزع هذه الإلكترونات بحيث تكون أبعد ما يمكن عن بعضها البعض ، بحيث تقلل من أثر التنافر بينها لتصبح في أركان مثلث متساوي الأضلاع مركزه ذرة البورون ، وتكون الزاوية ( (F B F) تساوي 120o

ملاحظة هامة : تعامل الروابط المضاعفة او الثلاثية معاملة الروابط الأحادية لأن الرابطة الأحادية أو الثنائية أو الثلاثية بين الذرتين تشغل نفس المنطقة من الفراغ
(2) زاوي (منحني) Angular أو شكل V - Shape V أوغيرخطي non -Linear
- هذه المركبات يرمز لها بـ AX2E أي أن الذرة المركزية A ترتبط بذرتين 2X وزوج غير رابط (حر) E.
- أي أن الذرة المركزية ترتبط بزوجين رابطين (أو مجموعتين من الأزواج الرابطة) وزوج حر.
- وفي هذه الحالة تكون الزاوية بين الروابط (X AX) اقل من 120o .
- ومن الأمثلة على هذا النوع :
-SO2 & SnCl2 & PbF2 & NOCl & NO2- & BH2
مثال(1): كلوريد القصدير SnCl2
- تركيب لويس هو:
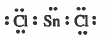
نلاحظ ان حـول الذرة المركزية زوجين رابطين وزوج حـر، وبذلك تتوزع هذه الإلكترونات بحيث تكون أبعد ما يمكن عن بعضها بحيث تقلل من أثر التنافر بينها لتتوزع في أركان مثلث مـسـتـو وحـيث أن الشكل الهندسي للـجـزيء يـحــدده أمـاكن الذرات وليس أماكن الأزواج الإلكترونية، لذا فإن الشكل الهندسي الصـحـيـح للجـزيء هو شكل زاوي ( منحني ) ( غير خطي) ( شکل V).

ملاحظة هامة: يختلف هذا الشكل عن الشكل ( مثلث مستو ) بان الزاوية (Cl Sn Cl) اقل من °120 وذلك لوجود زوج حـر (غير رابط ) الذي يمتلك طاقة أعلى وبذلك يسبب تنافر أكبـر ، ولهذا تبتعد عنه الأزواج الرابطة ، وبذلك تقل الزاوية عن °120 ، هذا من حيث الزاوية ، أما من حيث الذرات فالمثلث المستو يحتوي على ثلاث ذرات تحيط بالذرة المركزية أما الشكل غير الخطي فيحتوي على ذرتين تحيط بالذرة المركزية .