إذا كان حول الذرة المركزية خمسة مجموعات من الأزواج الإلكترونية
إذا كان حول الذرة المركزية خمسة مجموعات من الأزواج الإلكترونية فأن هناك أربعة احتمالات للشكل الهندسي الناتج:
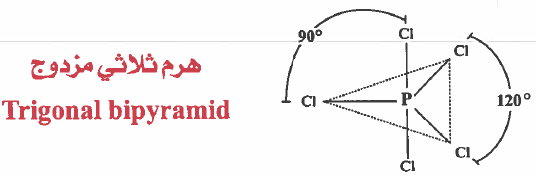
(1) هرم ثلاثي مزدوج Trigonal bipyramid
- هذه المركبات يرمز لها بـ AX5 ( أي أن الذرة المركزية A ترتبط بخمس ذرات 5X
- وفي هذه الحالة ترتبط الذرة المركزية بخمسة أزواج رابطة فقط .
- ومن الأمثلة على هذا النوع : PCl5 & SbCl5 & AsF5
مثال (1): خامس كلوريد الفسفور PCI5
- تركيب لويس هو :
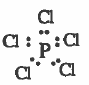
نلاحظ أن حـول الذرة المركزية (P) خمسة ازواج من الإلكترونات الرابطة ، وبذلك تـتـوزع هذه الإلكترونات بحيث تكون أبعد ما يمكن عن بعضها بحيث تقلل من اثر التنافر بينها ، لتشغل قمم هرمين ثلاثيين مشتركين في قاعدة واحدة مركزه ذرة الفسفور.
(2) هرم رباعي مشوه (رباعي السطوح مشوه) Irregular Tetrahedron
- هذه المركبات نرمز لها بـ AX4E أي أن الذرة المركزية A ترتبط بأربع ذرات 4X وزوج غير رابط (حر) E
حيث: A = تمثل الذرة المركزية & X = تمثل الذرة المرتبطة & E = زوج حر (غیر رابط)
- وهذا يعني أن الذرة المركزية ترتبط بأربعة أزواج إلكترونية رابطة وزوج غير رابط .
- ومن الأمثلة على هذا النوع :
TeCl4 & SF4 & SCl4 & R2SeCl2 & SeF4 & SeCl4 & TeF4
مثال (1): كلوريد التيليريوم TeCl4
- تركيب لويس هو:
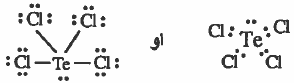
- نلاحظ أن حـول الذرة المركزية (Te) أربعة ازواج من الإلكترونات الرابطة وزوج غيـر رابط وبذلك تتوزع هذه الإلكترونات بحيث تكون أبعـد مـا يمكن عن بعـضـهـا بحيث تقلل من اثر التنافر بينها ، لتشغل قمم هرمين ثلاثيين مشتركين في قاعدة واحدة مركزه ذرة ( Te ) .
وحيث أن الشكل الهندسي للجزيء يحدده أماكن الذرات وليس أماكن الأزواج الإلكترونية ، لذا فإن الشكل الهندسي للجـزيء( TeCl4 ) هو هرم رباعي مـشـوه لأن الزوايا ليـست 109.5o

(3) شكل T - Shape T :
- هذه المركبات نرمز لها بـ AX3E2 أي أن الذرة المركزية A ترتبط بثلاث ذرات 3X وزوجين غیر رابطين (حرين) 2E
حيث: A = تمثل الذرة المركزية & X = تمثل الذرة المرتبطة & E = زوج حر (غیر رابط)
- وفي هذه الحالة ترتبط الذرة المركزية بثلاثة أزواج من الإلكترونات الرابطة وزوجين غير رابطين .
- ومن الأمثلة على هذا النوع :
ClF3 & BrF3 & XeF3+ & IF3 & ICl3
مثال (1): ثالث فلوريد الكلور CIF3
- تركيب لويس هو:

- نلاحظ أن حول الذرة المركزية (Cl) ثلاثة ازواج من الإلكترونات الرابطة وزوجين غير رابطين ، وبذلك تتوزع هذه الإلكترونات بحيث تكون أبعد ما يمكن عن بعضها بحيث تقلل من اثر التنافر بينها ، لتشغل قمم هرمين ثلاثيين مشتركين في قاعدة واحدة مركزه ذرة الكلور (C1)
وحيث أن الشكل الهندسي للجزيء يحدده أماكن الذرات وليس أماكن الأزواج الإلكترونية ، لذا فإن الشكل الهندسي للجزيء ( CIF3 ) هو حرف T .

(4) الشكل الخطي Linear
- وهذه المركبـات نـرمـز لـهـا بـ AX2E3 أي أن الذرة المركزية A ترتبط بذرتين وثلاثة أزواج غیر رابطة (حرة) 3E .
حيث: A = تمثل الذرة المركزية & X = تمثل الذرة المرتبطة & E= زوج حر (غیر رابط)
- وفي هذه الحالة ترتبط الذرة المركزية بزوجين رابطين وثلاثة أزواج غير رابطة
ومن الأمثلة على هذا النوع :
-XeF2 & I3- & Br3- & CIF2- & ICl2
مثال (1): -I3
- تركيب لويس هو :

- نلاحظ أن حول الذرة المركزية (I) زوجين رابطين وثلاثة ازواج غير رابطة ، وبذلك تتوزع هذه الإلكترونات بحيث تكون أبعد ما يمكن عن بعضها بحيث تقلل من أثر التنافر بينها ، لتشغل قمم هرمين ثلاثيين مشتركين في قاعدة واحدة مركزه ذرة اليود (I) .
وحيث ان الشكل الهندسي للجزيء يحدده أماكن الذرات وليس أماكن الأزواج الإلكترونية ، لذا فإن الشكل الشكل الهندسي للجزيء ( I3 ) هو خطي.
