إذا كان حول الذرة المركزية ستة مجموعات من الأزواج الإلكترونية
إذا كان حول الذرة المركزية ستة مجموعات من الأزواج الإلكترونية فأن هناك ثلاثة احتمالات للشكل الهندسي الناتج:
(1) ثماني أوجه منتظم Octahedral :
- هذه المركبات يرمز لها بـ AX6 ( أي أن الذرة المركزية A ترتبط بست ذرات 6X فقط
- وفي هذه الحالة ترتبط الذرة المركزية بستة أزواج رابطة فقط .
حيث A = تمثل الذرة المركزية & X = تمثل الذرة المرتبطة & E = زوج حر (غیر رابط)
- في هذه الحالة ترتبط الذرة المركزية بستة أزواج رابطة فقط.
- ومن الأمثلة على هذا النوع :
2-SF6 & PCl6- & SiF6-2 & PbCl6
- مثال : سادس فلوريد الكبريت SF6
- تركيب لويس هو :
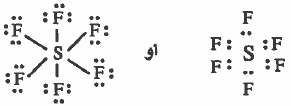
نلاحظ أن حول الذرة المركزية (S) سته ازواج رابطة ، وبذلك تتوزع هذه الإلكترونات بحيث تكون أبعد ما يمكن عن بعضها بحيث تقلل من أثر التنافر بينها ، لتشغل أركان الشكل ثماني الأوجه في قاعدة مربعة مركزها ذرة الكبريت (S)

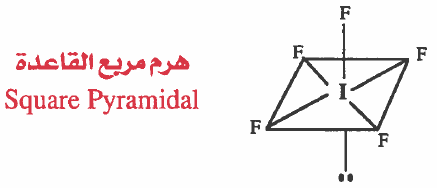
(2) هرم مربع القاعدة Square Pyramidal
هذه المركبـات نـرمـز لـهـا بـ AX5E أي أن الذرة المركزية A ترتبط بخـمس ذرات 5X وزوج غير رابط (حر) E .
حيث: A = تمثل الذرة المركزية & X = تمثل الذرة المرتبطة & E = زوج حر (غیر رابط)
- في هذه الحالة ترتبط الذرة المركزية بخمسة ازواج رابطة وزوج غير رابط .
ومن الأمثلة على هذا النوع : IF5 & BrF5
مثال (1): خامس فلوريد اليود IF5
- تركيب لويس هو:

نلاحظ ان حـول الذرة المركزية (I) خـمسـة ازواج رابطة وزوج غير رابط ، وبذلك تتوزع هذه الإلكترونات بحيث تكون أبعد ما يمكن عن بعضها بحيث تقلل من أثر التنافر بينها ، لتشغل أركان ثماني الأوجه في قاعدة مربعة في مركزها ذرة اليود (I)
وحيث أن الشكل الهندسي للجزيء يحدده أماكن الذرات وليس أماكن الأزواج الإلكترونية لذا فإن الشكل الهندسي للجزيء ( IF5 ) هو هرم رباعي القاعدة
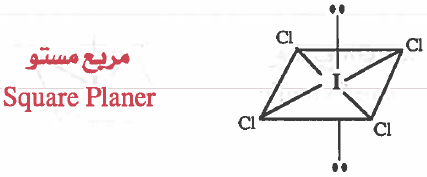
(3) مربع مستو Square Planer
- هذه المركبات نرمز لها بـ AX4E2 أي أن الذرة المركزية A ترتبط بأربع ذرات 4X وزوجين غير رابطين (حرين) 2E .
حيث: A = تمثل الذرة المركزية & X= تمثل الذرة المرتبطة & E = زوج حر (غیر رابط)
- وفي هذه الحالة ترتبط الذرة المركزية بأربعة ازواج رابطة وزوجين غير رابطين
- ومن الأمثلة على هذا النوع :
-XeF4 & ICl4- & IF4- & BrF4
مثال (1): رابع كلوريد اليود -ICl4
- تركيب لويس هو:

نلاحظ أن حـول الذرة المركزية (I) خـمسـة ازواج رابطة وزوج غير رابط ، وبذلك تتوزع هذه الإلكترونات بحيث تكون أبعد ما يمكن عن بعضها بحيث تقلل من اثر التنافر بينها ، لتشغل اركان ثماني الأوجه في قاعدة مربعة في مركزها ذرة اليود (I) .
وحيث أن الشكل الهندسي للجزيء يحدده أماكن الذرات وليس أماكن الأزواج الإلكترونية ، لذا فإن الشكل الهندسي للجزيء ( ICl4 ) هو مربع مستو .