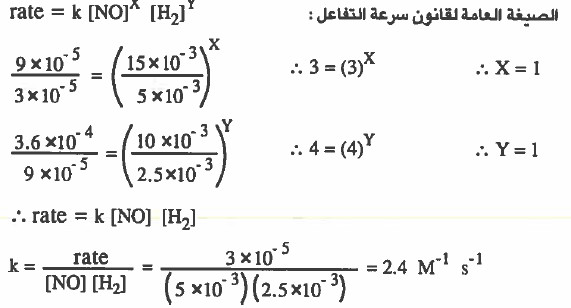مسائل محلولة على قانون سرعة التفاعل
مثال (1): أوجد رتبة التفاعل الكلية ، وأحسب قيمة ثابت سرعة التفاعل بين مادتين A, B فإذا كانت سرعة التفاعل هي 6-10 × 4 mol L-1 min-1 عند التراكيز 0.2mol L-1 لكل منهما ، والرتبة هي الأولى لكل منهما أيضاً .
الحل:
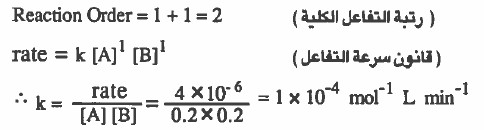
مثال (2): وجد عملياً أن رتبة التفاعل التالي هي الثانية:
CH3CHO → CH4 + CO
وأن معدل سرعة التفاعل 0.18mol L-1 min-1 حينما يكون تركيز الأسيتالدهيد يساوي 0.1mol L
(۱) اكتب قانون سرعة التفاعل
(۲) اوجد قيمة ثابت سرعة التفاعل
الحل:
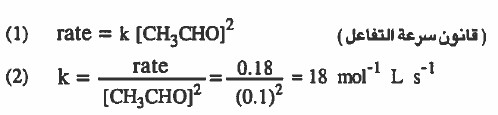
مثال (3): أجري التفاعل التالي:
2N2O3 → 4 NO + O2
فكانت النتائج التالية:
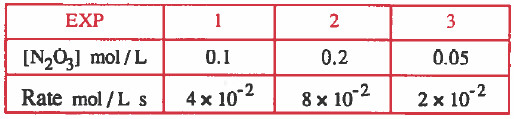
(1) حدد رتبة التفاعل.
(2) اكتب قانون سرعة التفاعل
(3) احسب قيمة k .
(4) إذا أصبح تركيز N2O3 يساوي 0.5mol / L فاحسب سرعة التفاعل
الحل:
(1) الصيغة العامة لقانون سرعة التفاعل عن كل تجربة على حدة هي كما يلي:
rate = k [N2O3]X
نقارن سرعات المادة N2O3 عند مضاعفة تركيز N2O3 ، ونلاحظ التغير في السرعة:


مثال (4): من المعلومات التجريبية للتفاعل التالي :
N2 + 2 H2O → 2 NO + 2 H2
تم الحصول على النتائج التالية:

أكتب قانون سرعة التفاعل واحسب قيمة ثابت سرعة التفاعل k .
الحل:
الصيغة العامة لقانون سرعة التفاعل عن كل تجربة على حدة هي كما يلي :
rate (1) = k [NO]X [H2]Y
rate (2) = k [NO]X [H2]Y
rate (3) = k [NO]X [H2]Y
نوجد رتبة التفاعل للمادة NO:
نقارن سرعات المادة NO عند ثبوت تراكيز المادة H2 ، ونلاحظ ان تراكيز المادة تثبت في التجربة (1) و (2) . لذا سوف نقسم السرعة في التجربة (2) على السرعة في التجربة (1) :
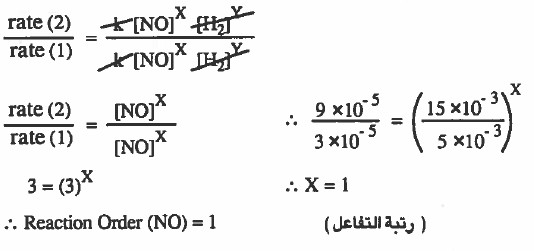
نوجد رتبة التفاعل للمادة H2:

حل مختصر للسؤال السابق .