الأملاح القاعدية Basic salts
- يسمى ملح من النوع الثالث Salt from the Third kind
- هذا الملح ينتج من تفاعل حمض ضعيف وقاعدة قوية .
- هي أملاح ذات اثر قاعدي أي أن (7 < pH) .
- عندما تذوب في الماء فإنها تتفكك إلى أيونات موجية وسالبة ، حيث يتميأ الأيون المشتق من الحمض الضعيف (يتفاعل مع الماء) لينتج أيونات الهيدروكسيد وبالتالي يكتسب المحلول الصفة القاعدية
- الملح القاعدي:
هو ملح ناتج عن تفاعل حمض ضعيف وقاعدة قوية
مثال توضيحي على الأملاح القاعدية
- ومن الأمثلة المعروفة على هذا النوع من الأملاح ملح خـلات الصوديوم (CH3COONa)
- وهو ناتج عن تفاعل حمض الخل (CH3COOH) (حمض ضعيف) وهيدروكسيد الصوديوم NaOH (قاعدة قوية) :
CH3COOH (aq) + NaOH (aq) → CH3COONa (aq) + H2O (l)
- وعند إذابة هذا الملح في الماء يتفكك إلى أيونات:
CH3COONa (s) → CH3COO- (aq) + Na+ (aq)
- وهنا يتميأ فقط الأيون المشتق من أصل ضعيف وهو أيون الخلات ( -CH3COO) المشتق من حمض الخل (حمض ضعيف)،حيث تتـفـاعـل أيونات الخـلات مـع الماء أيونات الهيدروكسيد:
-CH3COO- + H2O = CH3COOH + OH
- قانون ثابت الاتزان هو :
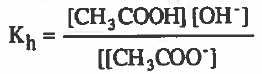
حيث ان : Kh = ثابت التميؤ
قانون محاليل الأملاح القاعدية
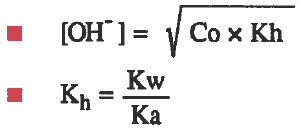
في هذه الحالة نستخدم القوانين التالية التي يمكن استنتاجها بطريقة رياضية
Co = التركيز الأصلي للملح القاعدي.
Kh = ثابت التميؤ (ثابت تفكك الأيون السالب) ويمكن الرمز له بـ Kb
مثال:
-CH3COO- + H2O = CH3COOH + OH
Kh (CH3COO-)= 5.6 x 10-10
-CH3COO- + H2O = CH3COOH + OH
Kb (CH3COO-)= 5.6 x 10-10
أمثلة إضافية على الأملاح القاعدية.
(1) خلات البوتاسيوم CH3COOK
وهذا الملح ناتج عن تفاعل حمض الخل CH3COOH وهيدروكسيد البوتاسيوم KOH
CH3COOH + KOH → CH3COOK + H2O
وعند وضع ملح خلات البوتاسيوم CH3COOK في الماء يتفكك إلى أيونات:
+CH3COOK → CH3COO- + K
وأيون الخلات (-CH3COO) يتميأ لينتج أيونات الهيدروكسيد:
-CH3COO-+ H2O → CH3COOH + OH
(2) سيانيد الصوديوم NaCN
- وهذا الملح ناتج عن تفاعل حمض الهيدروسيانيك HCN وهيدروكسيد الصوديوم NaOH
HCN + NaOH → NaCN + H2O
- وعند وضع ملح سيانيد الصوديوم NaCN في الماء يتفكك إلى أيونات:
-NaCN → K+ + CN
- وأيون السيانيد (-CN) يتميأ لينتج أيونات الهيدروكسيد:
-CN- + H2O = HCN + OH
(3) نيتريت الصوديوم NaNO2
وهذا الملح ناتج عن تفاعل حمض النيتروز HNO2 وهيدروكسيد الصوديوم NaOH
HNO2 + NaOH → NaNO2 + H2O
وعند وضع ملح نيتريت الصوديوم NaNO2 في الماء يتفكك إلى أيونات:
-NaCN → Na+ + CN
وأيون النيتريت (-NO2) يتميأ لينتج أيونات الهيدروكسيد:
-NO2- + H2O = HNO2 + OH
معلومات أضافية هامة للتذكر
- بعض الأحماض الضعيفة:
حمض الخل (CH3COOH) - حمض سيانيد الهيدروجين (HCN) - حمض الفورميك (HCOOH) - حمض البنزن (C6H5COOH)
- بعض القواعد القوية
هيدروكسيد الصوديوم (NaOH) هيدروكسيد البوتاسيوم (KOH)