تفاعل أكسدة الألدهيدات والكيتونات Oxidation of Aldehydes and Ketones
- تتأكسد الألدهيدات بسهولة وتتحول إلى الأحماض الكربوكسيلية المطابقة.
- في حين أن الكيتونات لا تتأكسد تحت نفس الظروف التي تتم عندها أكسدة الألدهيدات.
- ومن المواد المؤكسدة التي تستخدم لهذا الغرض البرمنجنات والكرومات وفوق الأكاسيد مثل فوق أكسيد الهيدروجين أو فوق أكسيد حمض الخل.
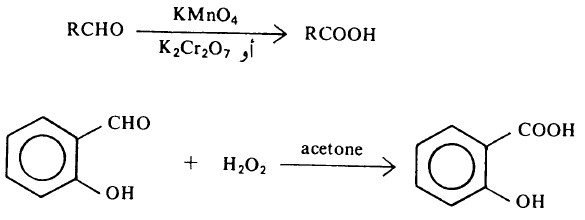
ونظراً لسهولة أكسدة الألدهيدات فإنه يمكن أكسدتها في وجود مواد مؤكسدة أضعف قوة من المواد المؤكسدة سابقة الذكر مثل كاشف تولينز Tollen’s Reagent محلول هيدروكسيد الفضة النشادري Ag(NH3)2]+ -OH] حيث يختزل أيون الفضة إلى الفضة المعدنية.
تفاعل اختزال الألدهيدات والكيتونات Reduction of Aldehydes and Ketones
- سبق وأن أشرنا أن الألدهيدات والكيتونات يمكن اختزالها إلى الكحولات الأولية والثانوية على التوالي.
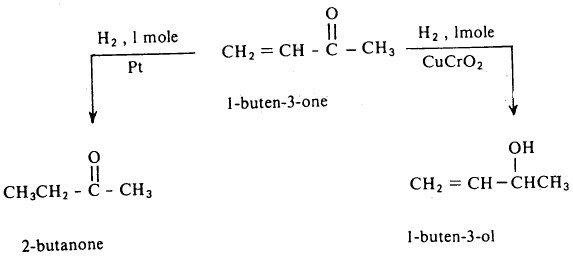
- وقد يتم الاختزال بوساطة الهيدروجين في وجود عامل مساعد (البلاتين أو البلاديوم أو النيكل) أو بوساطة مواد كيميائية مختزلة مثل LiAIH4
- للعامل المساعد أهميته في عملية الاختزال فإنه بالإمكان اختزال نوع معين من الروابط دون تأثر النوع الآخر عند وجود النوعين القابلة للاختزال معاً في الجزىء وذلك تبعاً لتغير العامل المساعد المستخدم، على سبيل المثال:
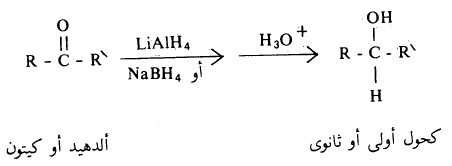
- تستخدم الكثير من المواد الكيميائية لاختزال مجموعة الكربونيل ولكن أكثر هذه المواد استخداماً في المختبرات هما LiAlH4 و NABH4.
- وتمثل كل من مادة LiAIH4 ومادة NaBH4 مصدراً لأيون الهيدريد (-:H) الذي يهاجم ذرة كربون مجموعة الكربونيل (تفاعل إضافة نيكلوفيلية) لينتج ناتج الإضافة (۱) الذي لا يزال في حد ذاته يحوي ثلاث أيونات هيدريد مرتبطة بذرة الألومنيوم وعليه فإن الأمر يحتاج إلى ٣ مولات أخرى من المركب الكربونيلي ليتكون ناتج الإضافة (۲)، بمعنى آخر تتفاعل أربعة مولات من المركب الكربونيلي مع مول واحد من LiAlH4
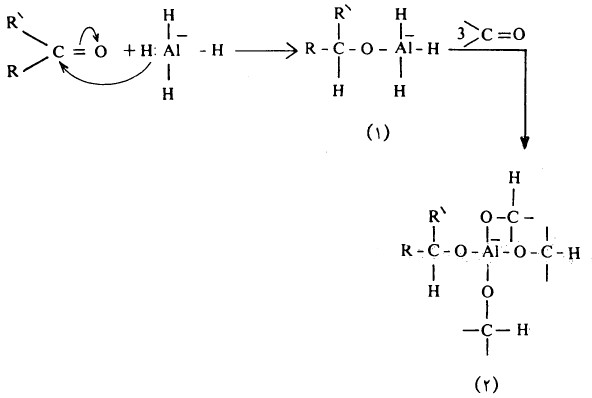
- وللتبسيط تكتب المعادلة السابقة وفقاً للآتي:
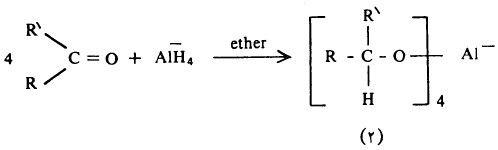
- هذا ويتم في خطوة أخرى إضافة الماء المحمض الذي يقوم بدوره بتكسير الروابط الأكسجين والألومنيوم وكذلك إضافة البروتون إلى الأكسجين كي ينتج المركب الكحولي.
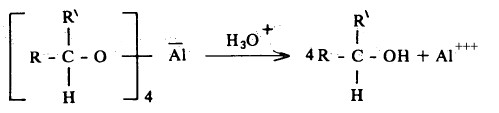
- ومما تجدر الإشارة إليه أن تفاعلات الاختزال بـ LiAlH4 يجب تتم في خطوتين منفصلتين تماماً:
أولاً/ تفاعل المركب الكربونيلي مع LiAlH4 وتحت ظروف جافة تماماً
- في الغالب يستخدم الايثر أو داى جليم Diglyme .
ثانياً/ التحلل بواسطة الماء (التميؤ).
- فمن الضروري بمكان فصل الخطوتين عن بعض نظراً للفعالية الشديدة التي تتمتع بها LiAlH4 مع المذيبات التي تمثل مصدراً للبروتونات مثل الماء أو الكحول.
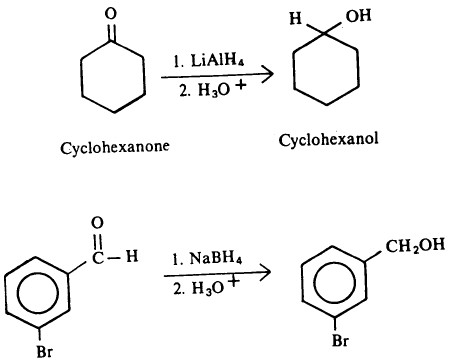
- ومن ناحية أخرى فإن NaBH4 تتفاعل ببطء مع الماء أو الكحول
- وعليه في الكثير من تفاعلات الاختزال بواسطة هذه المادة يستخدم الماء أو الكحول كمذيب.
- وقلة فعالية NaBH4 مقارنة بمادة LiAlH4 تجعل منها ميزة في اختزال مجموعة فعالة وعدم تأثر أخرى إذا ما وجدت هذه المجاميع في نفس الحزىء، على سبيل المثال:
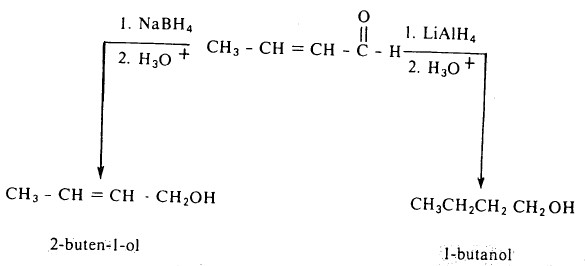
- كما ويمكن أن تتحول مجموعة كربونيل الألدهيدات والكيتونات إلى مجموعة مثيلين (-CH2-) ويتم ذلك بطريقتين سبق ذكرهما هما طريقة كلمنسن وطريقة وولف كيشنر.
- وناتج الاختزال واحد في الطريقتين بيد أن الاختلاف بينهما يكمن في الكواشف المستخدمة والوسط حيث تتم طريقة كلمنسن في الوسط الحمضي (وعليه تستخدم اختزال المركبات التي تتأثر بالقواعد)
- في حين تتم طريقة وولف في الأوساط القلوية.
- وتستخدم هاتان الطريقتان على نطاق واسع لتحضير الأرينات (الكيلات البنزين) وكبديل لألكلة فريدل - كرافتس.
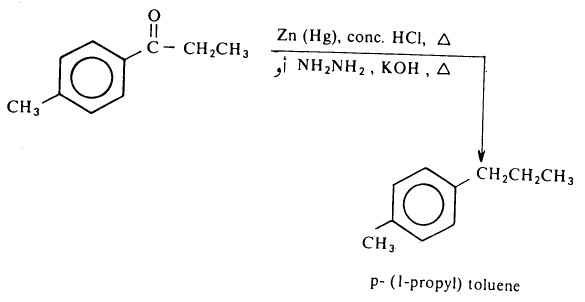
فإذا ما أريد تحضير ألكيل بنزين مثل بارا (۱ – بروبيل) طولوين من الألكلة المباشرة للبنزين فإن الناتج يكون خليطاً من ألكيلات البنزين.