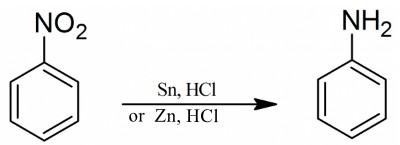
اختزال النيتروبنزين إلى أنيلين
- خذ أنبوب اختبار وضع فيه قطرة من نيترو بنزن C6H5NO2 وأضف إليها 3 قطرات من محلول HCl المركز وقطعة صغيرة (2×2 مم) من الزنك.
- خض الأنبوب خضاً مستمراً لكي لا يبقى النيتروبنزين على شكل طبقة زيتية طافية، ولكي يختلط في الوقت نفسه مع الهيدروجين المنطلق.
- إذا لاحظت أن التفاعل أخذ يتباطأ عندئذ سخن الأنبوب تسخيناً لطيفاً على لهب.
- استمر في إجراء التفاعل حتى تذوب قطعة الزنك كلها ، ولأجل ذلك يمكن إضافة قطرتين أخريين من محلول HC1 المركز.
- فإذا كانت كمية النيتروبنزين المأخوذة قليلة فإن الكمية كلها تتحول إلى الأنيلين أو بصورة أدق ، إلى ملحه مع HC1 الذي يذوب جيداً في الماء.
معادلة التفاعل
ويمكن توضيح التفاعل بالمعادلات التالية :
Zn + 2HC1 → H2↑ + ZnCl2
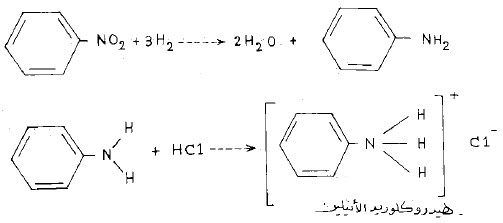
- ومن ملح هيدروكلوريد الأنيلين المتكون يمكن الحصول على الأنيلين الحر يجعل المحلول قلوياً بماءات الصوديوم.
- ويمكن جمع المعادلات السابقة معاً فى معادلة واحدة كالتالي: