تجربة تعيين حرارة التعادل
- يمكن افتراض الأحماض والقواعد القوية المخففة منحلة تماما إلى أيوناتها.
- كذلك تكون الأملاح المتكونة من تفاعل الأحماض والقواعد القوية منحلة تماماً بالمحاليل.
- لذا يمكن كتابة تعادل الحمض القوي بالقاعدة القوية كالتالي:
H+ + OH- → H2O
- لذا لا يعتمد الأثر الحراري للتفاعل على طبيعة الأيون للحمض (الأيون السالب الشحنة) والكاتيون للقاعدة (الأيون موجب الشحنة).
- وهذا ليس صحيحًا إلم يكن الحمض أو القاعدة متأيناً بشكل تام.
- حمض الخليك ذو تأين جزئي بالمحلول يمكن كتابة تعادله مع هيدروكسيد الصوديوم كالتالي:
CH3COOH + OH- → CH3COO- + H2O
أو إذا اعتبر كمرحلتين:
+CH3COOH → CH3COO- + H
H+ + OH- → H2O
- حرارة التعادل بهذه الحالة هي حرارة اتحاد أيونات الهيدروجين وأيونات الهيدروكسيد منقوصاً منها الطاقة المستخدمة لتفكيك أي جزيئة غير متأينة من حمض الخليك.
- يمكن تحديد حرارات التعادل بقياس بسيط للحرارة.
الأدوات والكيماويات اللازمة للتجربة
- قارورة (ديوار) ثرمس
- أنبوبة غليان
- قضيب زجاجي
- ترمومترين ( 50 → 0 مo) مدرجة لدقة 0.1 مo
- حمض الهيدروكلوريك
- هيدروكسيد الصوديوم
- حمض الخليك
- حمض النتريك
خطوات العمل لتجربة تعيين حرارة التعادل
- الخطوة الأولى هي تحديد المكافئ المائي للجهاز حيث يضاف 50 ملليمتراً من الماء المقطر مقاساً إلى قارورة الثرمس مع ملاحظة درجة حرارة الماء ولتكن t1 مo.
- كذلك يضاف 50 ملليمتراً إلى قارورة مغموسة بثرموستات عند درجة حرارية حوالي 30 مo ، ثم تترك القارورة ومحتوياتها لتصل إلى التعادل الحراري، ثم تلاحظ درجة حرارة الماء ولتكن t2 مo
- يسكب هذا الماء بسرعة بقارورة الثرمس ويحرك بسرعة، ثم تلاحظ أعلى درجة حرارة يصلها الخليط المائي ولتكن t3 مo
- هنا الحرارة المفقودة من الماء الساخن تساوي الحرارة التي اكتسبها الماء البارد وجدران قارورة الثرمس، لذا:
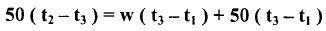
حيث تمثل w المكافئ المائي القارورة الثرمس.
- نلاحظ أنه بوجود 50 مليلتراً من هيدروكسيد الصوديوم العياري والخالي من الكربونات بقارورة الثرمس و 50 مليلتراً من حمض الهيدروكلوريك العياري بأنبوبة الغليان محمولة بسدادة الثرمس. حيث يحرك المحلولان حتى يصلا إلى درجة الحرارة نفسها ولتكن t4 مo
- يضرب قعر أنبوبة الغليان بالقضيب الزجاجي ليكسره وبذلك يختلط المحلولان القاعدي والحمضي.
- يحرك الخليط بسرعة وتسجل أعلى درجة حرارة يصلها الخليط ولتكن t5 مo.
- بفرض كتلة المحلول الكلية 100 جرامًا وحرارته النوعية واحد؛ لذا فالحرارة المتحررة عند خلط الحمض والقاعدة تساوي إلى:
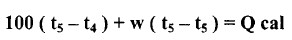
- والحرارة المتحررة من خلط لتر من الحمض العياري بلتر من القاعدة العيارية تساوي 20 كالوري لذا فحرارة تعادل حمض قوى بقاعدة قوية هي 20cal equivalent
- إلم تكن عياريتا الحمض والقاعدة متساويتين تمامًا فأيهما أضعف يتحكم في استمرارية التفاعل.
- فإذا كانت (x) عيارية المحلول الضعيف والحرارة المتحررة من خلط مليلتراً من الحمض مع 50 مليلترا قاعدة هي Qcal فإن حرارة التعادل ستساوي 20Q (cal) (equivalent
- يجب إعادة التجربة باستخدام حمض النتريك مع هيدروكسيد الصوديوم، ومن ثم حمض الخليك مع هيدروكسيد الصوديوم.