تفاعلات الإضافة الحلقية
- لقد مر علينا الكثير من التفاعلات التي تكون نواتجها مركبات حلقية، على سبيل المثال ، تفاعلات التكاثف مثل الألدول ومايكل لمركبات الكربونيل.
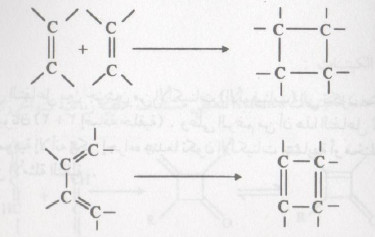
- هذا ويمكن أن تتداخل رابطتان مضاعفتان في جزئ واحد لتنشأ رابطة باي ورابطة سيجما.
- بصورة مماثلة، فإن النظام الذي له روابط مضاعفة في جزيئين مختلفين سيرتبطان معاً في جزيئ منفرد جديد.
- في كلتا الحالتين سوف يكون الإتحاد برابطتين سيجما تنشآن من رابطتين باي في الجزيئين الداخلين في التفاعل ، وتكون النتيجة مشتق لحلقة رباعية.
- مثل هذا التفاعل هو تفاعل إضافة ، ويطلق عليه مصطلح إضافة حلقية Cycloaddition)
تصنيف تفاعلات الإضافة الحلقية
- بصورة عامة فإن تفاعل الإضافة الحلقي هو إزدواج الجزيئين غير مشبعين ، كل منهما يحوي رابطة مضاعفة أو أكثر (متناوبة).
- يشار إلى تفاعل الإضافة الحلقي بقوسين يحتويان على عدد إلكترونات باي لكل مكون.
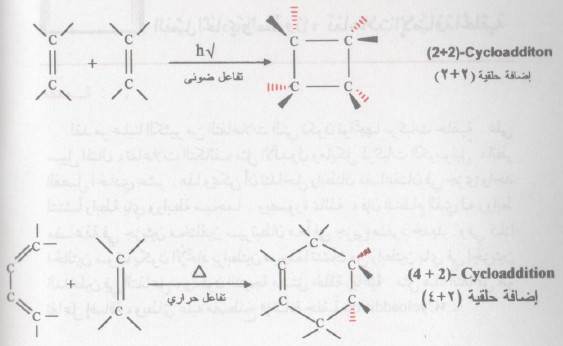
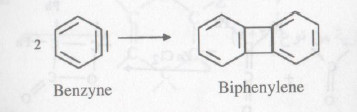
- يؤدي التفاعل بين جزيئين من الألكينات (الألوفينات) إلى تكون مشتقات سيكلو بيوتان (۲ + ٢ إضافة حلقية).
- على الرغم من أن هذا التفاعل لا يأخذ طابع العمومية إلا أنه يمكن إجراءه عندما تكون الألكينات متشابهة أو مختلفة كما يتضح من الأمثلة التالية:
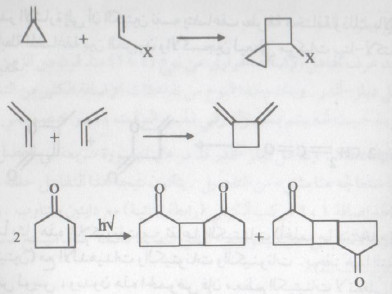
- على نفس النمط يتم تضاعف الرابطة الثلاثية:
تضاعف الكيتينات
- تتضاعف الكيتينات Ketenes لتعطي مشتقات حلقية رباعية كنوانج رئيسية.
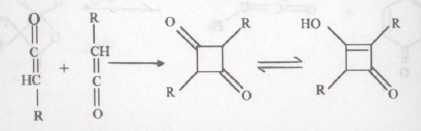
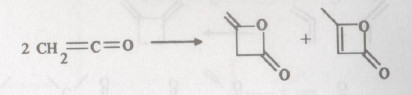
- تجدر الإشارة إلى أن الكيتين نفسه يتضاعف بطريقة مختلفة وذلك بالإضافة إلى الرابطة المضاعفة بين الكربون والأكسجين ليعطي مركبات بيتا لاكتونات غير مشبعة.
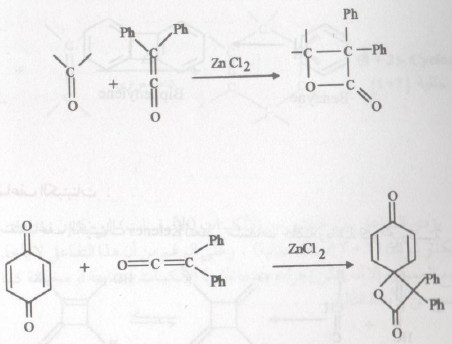
- تنشأ مثل هذه اللاكتونات من تفاعل الكيتينات (أغلب ما يستخدم ثنائي فنيل كيتين) مع الألدهيدات والكيتونات والكينونات.
- يحفز هذا التفاعل بأحماض لويس ، وبدون هذه الأحماض فإن معظم الكيتينات لا تعطي نواتج حيث أن الأخيرة تتكسر عند درجات الحرارة في غياب أحماض لويس.
تفاعل ديلز - ألدر
- لقد عرف تفاعل الإضافة الحراري من نوع (4 + 2) منذ قرن من الزمن تقريباً ، بتفاعل ديلز - ألدر .
- يخدم هذا النوع من تفاعلات الإضافة الكثير من التشييدات المخبرية حيث أنه يتم بسهولة وفي نفس الوقت ، فهو خصوصي فراغي Stereospicific .
- يتكون نتيجة تفاعل ديلز - ألدر حلقة سداسية بوساطة إضافة ١، ٤ لمركب ألكيني (رابطة ثنائية) مع دايئين متناوب.
- يسمى المركب الألكيني (دايئينوفيل) الذي ينشط دائماً بمجاميع ساحبة أ للإلكترونات (Z).
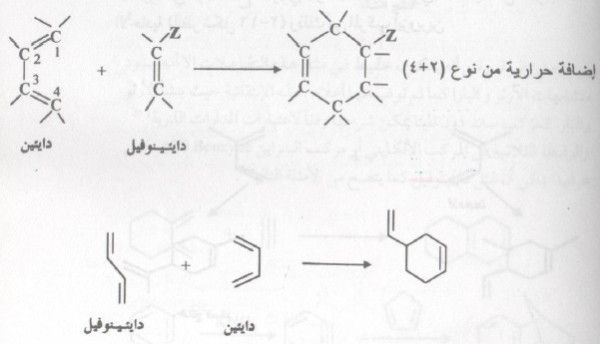
- في المثال الأخير فإن الرابطة المضاعفة تمثل مجموعة منشطة للدايئينوفيل . والمجاميع الساحبة ، الكربوكسيل ، الكيتون ، النيترو ، السيانيد ، هي الأكثر شيوعاً في الإستخدام كجزء من بناء الدايئينوفيل عند إستخدام تفاعل ديلز - ألدر في عمليات التشييد للمركبات العضوية .
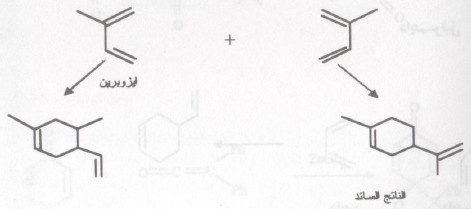
- هذا ولا يحتاج تفاعل ديلز - الدر إلى دايئينوفيل منشط وذلك إذا كان التفاعل مع دايئين نشط (يُنشط الدايئين بوساطة مجموعة معطية للإلكترونات). على سبيل المثال ، مركبات أحادي وثنائي وثلاثي مثيل ٣,١- بيوتادايئين أكثر نشاطاً من ۳,۱- بيوتادايئين نفسه.
- يؤدي تنشيط الدايئينوفيل أو الدايئين في تفاعل ديلز - الدر إلى حصيلة جيدة من النواتج . ويتكون خليط من نواتج هذا التفاعل عندما يتحد دايئين مع دايئين آخر مختلف أو عندما يكون مركب دايئيني واحد غير متناظر.
- تتمثل هذه الحالة الأخيرة في الإصطناع الحيوي (أو التحضير المخبري) للعديد من التربينات الأحادية وذلك من المركب أيزوبرين.
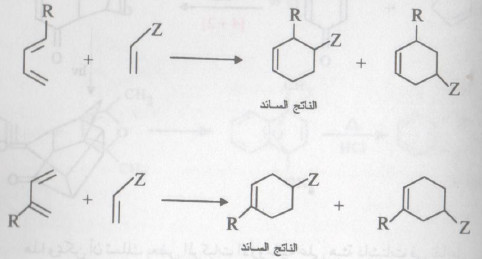
- كما يتكون ناتجان أيضاً عندما يتحد مركب دايئيني غير متناظر مع دايئينوفيل غير متناظر ، مثل:
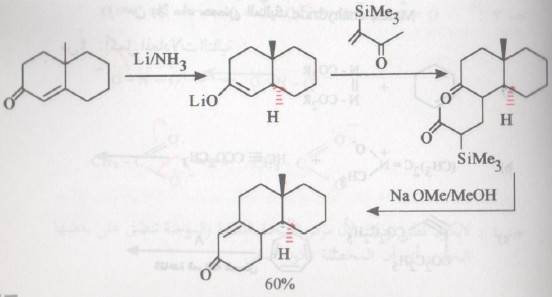
تفاعل روبنسن
- هذا التفاعل عبارة عن تفاعلين متتابعين هما إضافة مايكل ، يلي ذلك تكاثف الدول وينتج عن ذلك تكوين مركب حلقي.
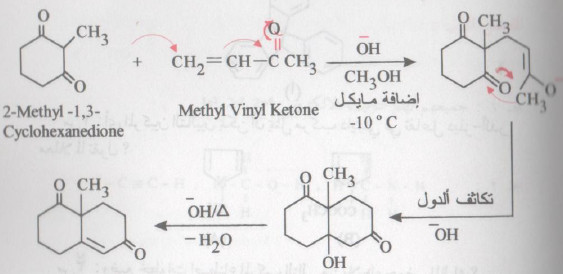
- تستخدم مجموعة ثلاثي ميثل سايليل في تفاعل روبنسن Robinson annulation لتحفيز إضافة مايكل عن طريق تأثير السليكون في تثبيت الكربانيون ، كما أن هذه المجموعة تعيق البلمرة للأنيون بسبب كبر حجمها.