ترتيب العناصر في الجدول الدوري الحديث
- الجدول الدوري الحديث The Modern Periodic Table هو الجدول الأكثر استخدامًا حالياً.
- يميز كل عنصر بالرمز الخاص به، ويوضع في مربع، ويكتب العدد الذري له أعلى الرمز ، في حين يكتب كل من الكتلة الذرية واسم العنصر أسفل الرمز.
- لاحظ أن العناصر قد رتبت بحسب الزيادة في العدد الذري من اليسار إلى اليمين ، ومن أعلى إلى أسفل.
- وضع الهيدروجين (H)، وهو أخف العناصر، في الركن الشمالي العلوي، والهيليوم (He)، وعدده الذري 2 ، في الركن اليمين العلوي، والليثيوم (Li)، وعدده الذري 3 ، في الطرف الشمالي للصف الثاني.
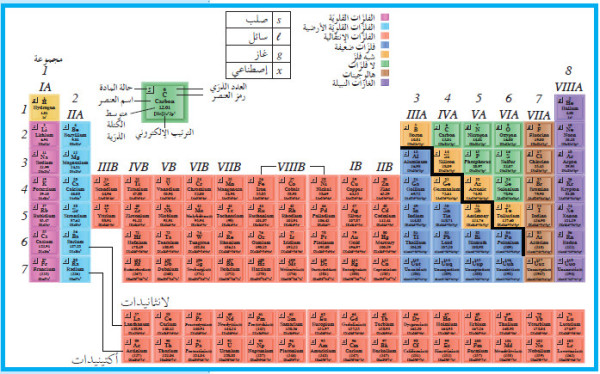
المجموعات والدورات Groups and Periods
- تُسمّى الصفوف الأفقية في الجدول الدوري الدورات Periods وتوجد سبع دورات . ويتراوح عدد العناصر لكل دورة ما بين 2 (الهيدروجين والهيليوم) في الدورة الأولى و 32 في الدورة السادسة.
- تتغير خواص العناصر داخل الدورة كلما انتقلنا عبر الدورة من عنصر إلى آخر.
- يتكرّر نمط الخواص داخل المجموعة كلّما انتقلنا من دورة إلى الدورة التي تليها.
- يقودنا هذا إلى القانون الدوري Periodic Law الذي ينص على:
(عند ترتيب العناصر بحسب ازدياد العدد الذرّي، يحدث تكرار دوري للصفات الفيزيائية والكيميائية)
- أما ترتيب العناصر في دورات فله نتيجة مهمة، إذ إنّ العناصر التي لها خواص فيزيائية وكيميائية متشابهة تتجمع في النهاية في العمود نفسه في الجدول الدوري.
- يُسمى كل عمود رأسي من العناصر في الجدول الدوري المجموعة أو العائلة Group.
- والعناصر ، في أي مجموعة في الجدول الدوري، لها خواص كيميائية وفيزيائية متشابهة .
- تتميّز كلّ مجموعة برقم روماني وحرف (إما A أو B).
- يوجد في الجدول الدوري:
المجموعات: 18 مجموعة وهي:
- 8 مجموعات رئيسية A
- 10 مجموعات رئيسية B
الدورات:
- 7 دورات رئيسية
- دورتان فرعيتان أو دورتان داخليتان (اللانثانيدات / الدورة السادسة والأكتينيدات / الدورة السابعة)