التفاعلات الانعكاسية Reversible reactions
- تسمى أيضاً بالتفاعلات الكيميائية غير التامة أو التفاعلات العكسية.
- وهي التفاعلات الكيميائية التي يتم فيها تحول المواد المتفاعلة الى نواتج في بداية التفاعل، ويكون للمواد الناتجة المقدرة على أن تتفاعل مع بعضها لتكوين المواد التي تكونت منها مرة أخرى.
- فى هذا التفاعل لا تستهلك المواد المتفاعلة فيها كلياً بسبب أن المواد الناتجة تبدأ بتكوين المواد المتفاعلة ويستمر هذا الوضع مهما طال وقت التفاعل، أي لايتم فيها استهلاك المواد المتفاعلة تماماً، ويؤشر ذلك في المعادلة بوضع سهمين متعاكسين للدلالة على ذلك.
التفاعلات الأنعكاسية والأتزان الكيميائي
- التفاعل العكسي هو التفاعل الكيميائي الذي يحدث فى الاتجاهين الأمامي والعكسي.
(N2(g) + 3H2(g) → 2NH3(g : التفاعل الأمامي
(N2(g) + 3H2(g) ← 2NH3(g :التفاعل العكسي
يدمج الكيميائيون المعادلتين في معادلة واحدة يستعمل فيها السهم الثنائي ليشير إلى اتجاهي التفاعلين الحادثين
(N2(g) + 3H2(g) ⇋ 2NH3(g
- تكون المتفاعلات للتفاعل الأمامي فى الجهة اليسرى من الأسهم فى حين تكون المتفاعلات للتفاعل العكسي في الجهة اليمنى من الأسهم.
- في التفاعل الأمامي يتحد النيتروجين والهيدروجين لتكوين الأمونيا. أما في التفاعل العكسي فتتحلل الأمونيا لتكوِّن كلاً من غاز الهيدروجين وغاز النيتروجين.
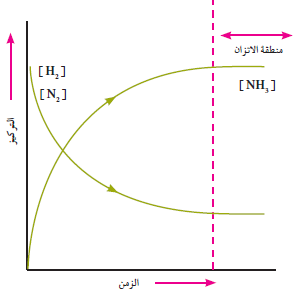
- في بداية هذا التفاعل يكون التفاعل الأمامي سريعاً وتكون سرعة التفاعل الأمامي Rf حيث f من forward وتعني أمامي باتجاه تكوين الامونيا
- بمرور الوقت وبزيادة تركيز الامونيا وعند ظروف التفاعل نفسها تتحلل الامونيا الناتجة لتكوين غازي H2 مع N2 بسرعة مقدارها سرعة التفاعل الخلفي Rb حيث b من backward وتعني خلفي.
- يستمر كلا التفاعلين بالاتجاهين المتعاكسين (الامامي والخلفي) حتى يصل التفاعل إلى حالة معينة تتساوى عندها سرعتي التفاعلين الامامي والخلفي Rf = Rb فيصل التفاعل الى حالة تدعى بحالة الأتزان الكيميائي.
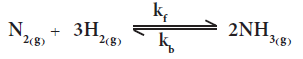
حيث Kf يمثل ثابت سرعة التفاعل الامامي و Kb يمثل ثابت سرعة التفاعل الخلفي.
الأتزان الكيميائي Chemical equilibrium
هو حالة النظام عندما تتساوى سرعتى التفاعل الأمامي والعكسي وعندها تثبت تراكيز المواد المتفاعلة والناتجة
سرعة التفاعل الأمامي = سرعة التفاعل العكسي
تظهر التفاعلات التي تصل الى حالة الاتزان وكأنها قد توقفت، لكنها في الحقيقة لاتزال مستمرة وتجري في كلا الاتجاهين، لأن حالة الاتزان الكيميائي هي حالة اتزان ديناميكي (حركي) وليست حالة اتزان استاتيكي (ساكن). أي أن التفاعل مستمر وبكلا الاتجاهين الامامي والخلفي بالمقدرة والسرعة ذاتها.
بعبارة اخرى لهذا التفاعل يكون معدل سرعة التكوين تساوي معدل سرعة التفكك، وتكون تراكيز المواد الناتجة والمتفاعلة عند حالة الاتزان ثابتة دون تغير، مالم يحدث أي تغيير على الظروف التي يتم عندها التفاعل