السالبية الكهربية وتحديد نوع الترابط بين الذرات
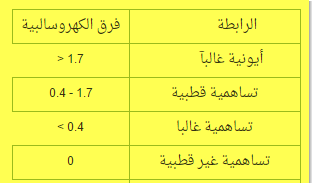
يتم تحديد نوع الروابط الكيميائية بين الذرات حسب الفرق في السالبية الكهربية بين الذرات كما هو موضح بالجدول :
الرابطة التساهمية القطبية
رابطة تنشأ عندما لا يتوزع الزوج الإلكتروني بين الذرتين المرتبطتين بالتساوي ، فالذرة الأكثر سالبيه كهربية تجذب إلكتروني التكافؤ بصورة أكبر وتكون شحنتها سالبة جزيئية( ᵟ-)على العكس الذرة الأقل سالبية كهربية تتكون عليها شحنة موجبة جزيئية ( ᵟ+ ).
الرابطة التساهمية الغير القطبية
رابطة تنشأ عندما يتوزع الزوج الإلكتروني للذرتين المرتبطتين بالتساوي
أمثلة للتوضيح
(1) إذا كان فرق السالبية الكهربية بين العنصرين ( أكبر من 1,7 ) تكون الرابطة أيونية
مثال: NaCl = 3 – 9 = 2.1
(2) إذا كان فرق السالبية الكهربية ( أقل من 1,7 ) تكون الرابطة تساهمية قطبية
مثال: H2O = 3.5 – 2.2 = 1.3
(3) إذا كان فرق السالبية = صفر يكون تساهمي نقي
مثال: Cl2 = 3.16 – 3.16 = صفر
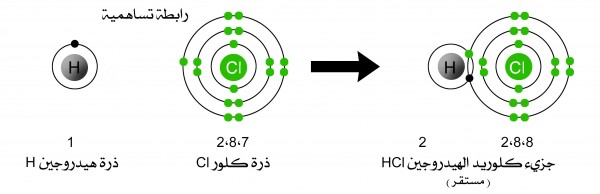
تحديد نوع الرابط فى جزئ كلوريد الهيدروجين HCl
السالبية الكهربية للكلور = 3.16
السالبية الكهربية للهيدروجين = 2.2
الفرق فى السالبية = 2.2 -3.16 = 0.96
إذا الفرق فى السالبية بين الكلور والهيدروجين أقل من 1.7 إذا الرابطة التى تربطهم رابطة تساهمية قطبية
الرابطة التساهمية القطبية فى كلوريد الهيدروجين