قانون هس Hess’s Law
- یعترض الكیمیائیین بعض الصعاب أحیاناً حینما یودون إیجاد الأنثالبي للتفاعلات، فقد تكون ھذه التفاعلات سھلة جداً للدرجة التي یصعب معھا دراستھا أو تنتج بعض المركبات الغیر مطلوبة نتیجة للتفاعلات الجانبیة.
- یستخدم قانون ھس لحساب كمیة الحرارة المصاحبة حیث یتعذر قیاسھا مخبریاً وذلك لعدة أسبابا منها:
(1) بطء شدید للتفاعل بحیث تتعذر دراسته.
(2) أو حدوث تفاعلات جانبیة تنتج مواد غیر مرغوب فیھا بجانب المواد المطلوبة.
(3) وجود مخاطر عند قياس حرارة التفاعل بطريقة تجريبية.
(4) وجود صعوبة عند قياس حرارة التفاعل في الظروف العادية من الضغط ودلرجة الحرارة.
نص قانون هس Hess’s Law
ينص قانون هس على أن:
"عند ثبوت الضغط ودرجة الحرارة، فإن التغیر في الإنثالبي (ΔH) لأي تفاعل كیمیائي مقدار ثابت، سواء تم ھذا التفاعل في خطوة واحدة أو مجموعة خطوات، بشرط أن تكون المواد المتفاعلة والناتجة ھي نفسھا في كل حالة".
أهمية قانون هس
(1) یمكن من خلاله حساب تغیرات الإنثالبي لتفاعلات لا یمكن إجراؤھا في المختبر بسبب بطئھا الشدید.
(2) یمكن استخدامه لحساب التغیر في الإنثالبي للتفاعلات التي فیھا نواتج جانبیة.
الصيغة الرياضية لقانون هس
من الشكل:
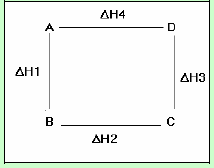
ΔH4 تمثل الإنثالبي لتكون (D) مباشرة من (A)
** وطبقاً لقانون ھس فإن :
ΔH4 = ΔH1 + ΔH2 + ΔH3
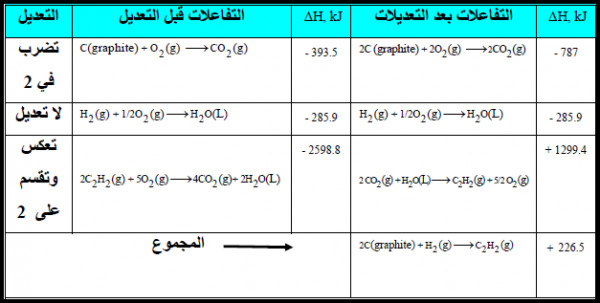
تمرين محلول على قانون هس
أحسب حرارة التفاعل التالي: ΔHo = ؟
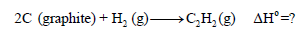
إذا علمت التفاعلات التالیة:
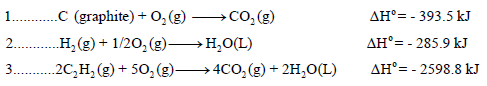
الحل: