يتوقف هذا التفاعل وسرعته على تدرج نشاط العناصر البروم والكلور والنيتروجين فى الجدول الدوري.
(1) تفاعل الهيدروجين مع الكلور أسرع من تفاعل الهيدروجين مع البروم
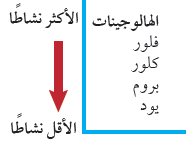
- لأن الكلور يسبق البروم فى المجموعة 17
- الكلور أنشط من البروم وذلك لأن نصف قطر الذرة للكلور atomic radius أقل حيث يحتوى على عدد مستويات طاقة أقل والترابط الالكتروني electronic Bonding يكون أقوي بكثير والألكترونات تكون قريبة جداً من النواة لذلك من السهل على الكلور ان يجذب الالكترونات من مادة أخري إلى مستوى طاقته الخارجي مكوناً روابط قوية جداً .
- كلما اتجهنا لإسفل فى المجموعة تزداد عدد مستويات الطاقة الخارجية مما يؤدي إلى زيادة المسافة بين النواة والألكترونات فى مستوى الطاقة الخارجي مما يضعف قوة الجذب بينهما لذلك يقل نشاط عناصر الهالوجينات كلما اتجهنا لأسفل.
- بالإضافة الى الأسباب السابقة فأن الكلور أنشط من البروم لأنه يسبقه فى متسلسلة النشاط الكيميائي للهالوجينات لذلك فهو الأسرع والأنشط
(2) تفاعل الهيدروجين مع النيتروجين أعلى من تفاعل الهيدروجين مع الكلور
بنفس التفسير السابق نجد أن نصف قطر ذرة النيتروجين أقل من نصف قطر ذرة الكلور وذلك لأنه بزيادة العدد الذرى تزيد الشحنة الموجبة فتزيد قوة جذبها للإلكترونات في مستويات الطاقة الخارجية .فتنسحب الإلكترونات نحو النواة مما يؤدي إلى أن الترابط الالكتروني electronic Bonding يكون أقوي بكثير والألكترونات تكون قريبة جداً من النواة لذلك يكون قدرة النيتروجين على التفاعل أسرع من الكلور.
- وعلى ذلك ومن وجهى نظري المتواضعة يكون الترتيب التالي حسب الأسرع فى التفاعل مع الهيدروجين:
N2 > Cl2 > Br2
- يمكن تفسير ذلك أيضاً عن طريق السالبية الكهربية فالسالبية الكهربية للنيتروجين أعلى من الكلور أعلى من البروم.
فالأكثر سالبية كهربية هو الأسرع والأنشط فى التفاعل حيث تزداد قدرة الذرة على جذب إلكترونات الرابطة الكيميائية وميلها الشديد للتفاعل الكيميائي.