استثناءات القاعدة الثمانية Exceptions to the Octet Rule
عادة ما تحصل الذرات عىل ثمانية إلكترونات عندما تتحد بذرات أخرى. ولكن بعض الأيونات والجزيئات لا تتبع القاعدة الثمانية. وهناك بعض الأسباب لهذه الاستثناءات.
(1) العدد الفردي من إلكترونات التكافؤ
يمكن أن يكون لمجموعة صغيرة من الجزيئات أعداد فردية لإلكترونات التكافؤ، ولا تستطيع أن تكوّن ثمانية إلكترونات حول كل ذرة.
- مثال فى جزئ NO2 له خمسة إلكترونات تكافؤ من النيتروجين و 12 من الأكسجين، أيْ أن المجموع 17 إلكترون تكافؤ، لذا لا يمكنه تكوين عددٍ صحيحٍ من أزواج الإلكترونات.
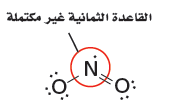
- لا تحقق ذرة النيتروجين المركزية في جزيء القاعدة الثمانية. فهي تحتوي على سبعة إلكترونات فقط في مستوى الطاقة الخارجي.
- الجزئيات NO ،ClO2 أمثلة أخرى على جزيئات ذات إلكترونات تكافؤ فردية العدد.
(2) حالات الاستقرار بأقل من ثمانية إلكترونات والرابطة التساهمية التناسقية
- تُعزي الحالات الاستثنائية الأخري للقاعدة الثمانية إلى وصول بعض المركبات إلى التركيب المستقر بأقل من ثمانية إلكترونات حول الذرة. وهذه المجموعة نادرة الوجود.
- مثال: جزئ BH3
- يوجد البورون في المجموعة 13 ، وهو عنصر شبه فلزي، ويكوّن ثلاث روابط تساهمية مع ذرات لا فلزية أخرى.
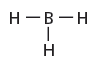
- تتشارك ذرة البورون بستة إلكترونات فقط؛ أي لا تتبع القاعدة الثمانية. وتكون مثل هذه المركبات في الغالب قابلة للتفاعل، لأنّ لها القابلية لاستقبال زوج من الإلكترونات من ذرة أخرى.
- تتكون الرابطة التساهمية التناسقية عندما تقدم إحدى الذرات إلكترونين لتشارك بهما ذرة اخرى أو أيوناً آخر بحاجة إلى إلكترونين ليكونا ترتيباً إلكترونياُ مستقراُ بأقل طاقة وضع.
- الشكل التالي يوضح تفاعل ثلاثي هيدريد البورون والأمونيا حيث تقدم ذرة النيتروجين إلكترونين يتم مشاركتهما بين البورون والأمونيا لتكوين رابطة تساهمية تناسقية

- عادة ما تكون الذرات أو الأيونات ذات الأزواج غير الرابطة روابط تساهمية تناسقية مع ذرات أو أيونات تحتاج إلى إلكترونين إضافيين.
(3) حالات الاستقرار بأكثر من ثمانية إلكترونات
- من المركبات التي لا تتبع القاعدة الثمانية ذرة مركزية تحتوي على أكثر من 8 إلكترونات تكافؤ.
- ويمكن تفسير ذلك بالأخذ بعين الاعتبار المستوى (d) الذي يوجد في مستوىات طاقة عناصر الدورة الثالثة وما بعدها.
- مثال : جزئ PCl5
- ويبين الشكل التالي كيف تصل ذرة الفوسفور في جزئ PCl5 إلى حالة الاستقرار بأكثر من ثمانية إلكترونات؛ إذ تتكون خمس روابط من عشرة إلكترونات مشتركة في مستوى (s) واحد ، وثلاثة مستويات (P) ، ومستوى (d) واحد.

- قبل تفاعل PCl3 ، Cl2 تتبع كل ذرة في المادة المتفاعلة القاعدة الثمانية . وبعد التفاعل ينتج PCl5 الذي لا تتبع ذرة الفوسفور فيه القاعدة الثمانية.
مثال آخر: جزئ SF6
- يحتوى جزئ SF6على ست روابط تتشارك في 12 إلكتروناً في مستوى (s) ، وثلاثة مستويات (P) ، واتنين من مستوىات (d)
- عندما نرسم تركيب لويس لهذة المركبات فإما أن نضيف أزواج إلكترونات غير رابطة للذرة المركزية، أو أن يكون هناك أكثر من أربع ذرات ترتبط في الجزيء.