ثابت الأتزان (K)
K = ثابت الأتزان عموماً
Kc = ثابت الاتزان قى حالة وجود التركيزات المولارية فى تعبير فعل الكتلة
Kp = ثابت الأتزان فى حالة وجود الضغوط الجزئية للغازات (ضغط الغاز هو تركيز الغاز)
- وفي التفاعلات التي تتضمن غازات، تكون الضغوط الجزئية للمواد المتفاعلة والناتجة من التفاعل متناسبة مع تركيزاتھا المولارية. لذلك، يمكن كتابة تعبير ثابت الإتزان لھذه التفاعلات باستعمال الضغوط الجزئية بدلاً من التراكيز.
- فمثلاً يمكن التعبير عن شرط الإتزان للتفاعل بين غاز النيتروجين N2 وغاز الھيدروجين H2.
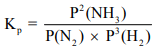
- الرمز Kp يستعمل ليدل على ثوابت الإتزان المشتقة من الضغوط الجزئية، و Kc لتدل على ثوابت الإتزان عن وجود التركيزات المولارية في تعبير فعل الكتلة.
-عموما (Kc) ,(Kp) ليسا متساويين عددياً إلإ في حالة التفاعل المتجانس الغازي الذي عدد مولات المتفاعلات الغازية يساوي عدد النواتج الغازية (nP = nR).
- التعبير السابق لثابت الإتزان يعرف بتعبير فعل الكتلة.
- قد كتب تعبير فعل الكتلة بالتركيزات (أو الضغوط الجزئية) للنواتج في البسط وللمواد المتفاعلة في البسط وللمواد المتفاعلة فى المقام
- ولما كان ھذا الكسر مساويا ً لمقدار ثابت عند الإتزان، فإن مقلوبه أيضا يجب أن يكون مقدارا ًثابتاً وبذلك :
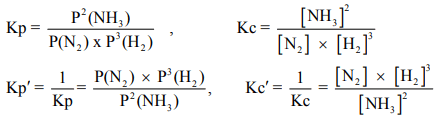
- ويعتبر كلا الوصفين لحالة الإتزان صحيحاً. إلإ أن الكيميائيين قد اختاروا، بشكل مطلق (اعتباطي ، عشوائي) الى حد ما، أن يكتب تعبير الإتزان، دائماً بحيث تظھر التركيزات أو الضغوط الجزئية للمواد المتفاعلة في المقام.