التمييز بين الإيثانول والفينول
- من أهم الكواشف التى تميز الفينولات عموماُ هو كاشف كلوريد الحديدك
- تفاعل كلوريد الحديدك مع الفينول يعطى لون بنفسجي حيت تتكون معقدات مع الحديد.
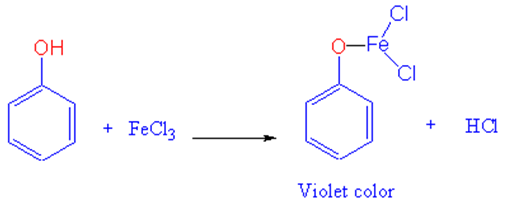
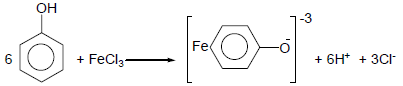

- أما عند إضافة كلوريد الحديدك إلى الكحولات فلا تتفاعل فى الظروف العادية وتعطي محاليل غير ملونة.
لماذا لا يتفاعل كلوريد الحديديك مع الإيثانول ويتفاعل مع الفينول
- لا يتفاعل الأيثانول مع كلوريد الحديديك لأن الإيثانول له خواص حمضية ضعيفة جداُ غير كافية للتفاعل مع كلوريد الحديديك على عكس الفينول الذي له خواص حمضية أعلى من الأيثانول حيث يتكون ايون الفينوكسيد -phO الأكثر ثباتاُ أو معقد الفينول -الحديد.
- فى المعادلات التالية:
+C2H5OH → C2H5O- + H
+C6H5OH → C6H5O- + H
نتيجة الخواص الحامضية لكلاً من الفينول والأيثانول نحصل على أيون ethoxide و phenoxide ويكون أيون الفينوكسيد أكثر ثباتاً وذلك بسب وجود الرنين على حلقة البنزين.
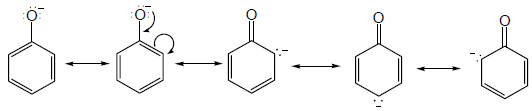
- يفسر ارتفاع حمضية الفينولات عن الكحولات على أساس الرنين في حلقة الفينيل الذي يؤدي إلى سحب الإلكترونات على ذرة الأكسجين في مجموعة الهيدروكسيل فيقل تركيز الشحنة السالبة الجزئية عليها فيساعد ذلك على خروج البروتون من جزئ الفينول ويصبح أيون الفينوكسيد مثبت بالرنين أكثر في جزئ الفينول.
تكون أيون الفينوكسيد السالب والأكثر ثباتاُ فى الفينول هو السبب فى تفاعل كلوريد الحديدك مع الفينول ولا يتفاعل مع الإيثانول.
ملحوظة هامة: -
عند تسخين محلول مكون من كلوريد الحديديك مع الأيثانول يحدث تفاعل أكسدة وأختزال ويتكون كلوريد الحديدوز FeCl2 ويختزل الأيثانول إلى الأسيتالدهيد.
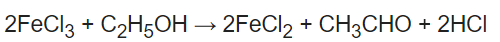
أى أن كلوريد الحديدك لا يتفاعل مع الأيثانول فى الظروف العادية ولكن يتفاعل عند التسخين وعامل حفاز مناسب.