أولاً/ ثابت تأين الحمض Ka
- ثابت تأين الحمض Ka : هو نسبة حاصل ضرب التركيز للقاعدة المرافقة بتركيز كاتيون الهيدرونيوم إلى تركيز الحمض عند الأتزان.
- القانون الرياضي لحساب ثابت تأين الحمض:

أمثلة لحساب ثابت التأين للأحماض Ka
مثال (1) : حساب ثابت التأين لحمض الأستيك
- المعادلة التالية توضح تأين حمض الأستيك فى الماء
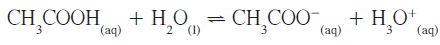
- ويمكن كتابة تعبير ثابت الاتزان كالتالي:
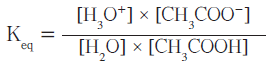
- يعتبر تركيز الماء فى المحاليل المخففة ثابتاُ وعلية يمكن ضرب تركيز الماء بثابت الأتزان Keq لينتج ثابت تأين الحمض الضعيف أحادى البروتون.
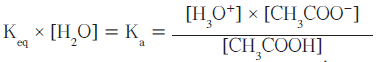
مثال (2): حساب ثابت التأين لحمض الهيدروسيانيك

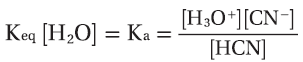
- يمكن التعبير عن تأين الحمض بالرمز pKa حيث أن :
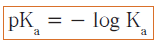
ملاحظات هامة على Ka
(1) لا يوجد ثابت تأين للأحماض القوية لأنها تتأين بشكل تام.
(2) الأحماض القوية هى الأحماض التى تتأين بشكل كامل فى المحلول وتنتج أكبر عدد من الأيونات.
(3) الأحماض الضعيفة هى الأحماض التى تتأين جزئياُ فقط فى المحلول المائي المخفف وتنتج أيونات أقل.

(4) إذا كانت قيمة ثابت التأين صغيرة فأن درجة تأين الحمض فى المحلول تكون صغيرة. ففى الأحماض الضعيفة قيم Ka صغيرة
(5) القيمة الأكبر لـ Ka تعنى أن تأين الحمض يتم بدرجة أكبر والحمض الأقوى له قيمة Ka أكبر.
مثال : Ka لحمض النيتروز = 4-10× 4.4 , Ka لحمض الأستيك = 5-10× 1.8 وعلى ذلك تكون قيمة Ka لحمض النيتروز أكبر وهذا يعنى أن حمض النيتروز أكثر تأيناُ فى المحلول من حمض الأستيك وبالتالي يكون حمض النيتروز أقوى من حمض الأستيك.
(6) كلما كانت قيمة pKa أكبر كلما صغرت قيمة Ka وكان الحمض أضعف والعكس صحيح.
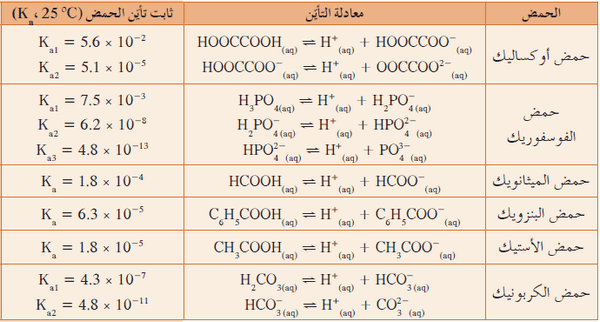
ثابت التأين للأحماض ثنائية البروتون وثلاثية البروتون
- تفقد الأحماض ثنائية البروتون والأحماض ثلاثية البروتون ذرات الهيدروجين واحدة تلو الأخرى ولا يتم تأين ذرات الهيدروجين فى تفاعل واحد.
- إذ أن كل تأين ذرة هيدروجين له تفاعل منفصل عن الذرة الأخري ويكون لكل تفاعل ثابت التأين الخاص به.
- حمض الفوسفوريك H3PO4 يحتوى على ثلاث ذرات هيدروجين لذلك فيكون له ثلاث ثوابت تأين
- يكون الحمض فى مرحلة التأين الأولى أقوى وثابت تأين المرحلة الأولى أكبر
ثانيأً/ ثابت تأين القاعدة Kb
- ثابت تأين القاعدة Kb : نسبة حاصل ضرب تركيز الحمض المرافق بتركيز أنيون الهيدروكسيد إلى تركيز القاعدة عند الأتزان
- القانون الرياضي لحساب ثابت تأين القاعدة Kb

- يمكن التعبير عن تأين الحمض بالرمز pKb حيث أن :
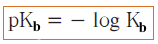
أمثلة لحساب ثابت التأين للقواعد Kb
مثال (1): حساب ثايت التأين للأمونيا
- المعادلة التالية توضح تأين الأمونيا فى الماء
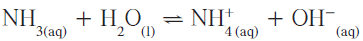
فيكون ثابت الأتزان للتفاعل كالتالي:
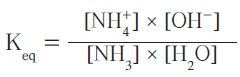
- يعتبر تركيز الماء فى المحاليل المخففة ثابتاُ وعليه يمكن ضرب تركيز الماء بثابت الأتزان Keq لينتج ثابت تأين القاعدة
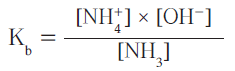
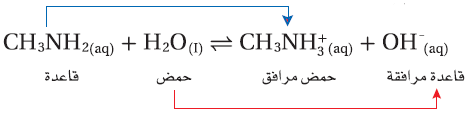
مثال (2): حساب ثابت التأين Kb للأيثيل أمين
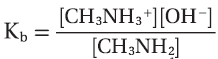
ملاحظات هامة على Kb
(1) لا يوجد ثابت تأين للقواعد القوية لأنها تتأين بشكل تام.
(2) القواعد القوية هى القواعد التى تتأين بشكل كامل فى المحلول وتنتج أكبر عدد من الأيونات. مثل هيدروكسيد الصوديوم - هيدروكسيد الكالسيوم - هيدروكسيد الماغنسيوم
(3) القواعد الضعيفة هى القواعد التى تتأين جزئياُ فقط فى المحلول المائي المخفف وتنتج أيونات أقل مثل هيدروكسيد الأمونيوم
(4) كلما كانت قيمة pKb أكبر كلما صغرت قيمة Kb وكان الحمض أضعف والعكس صحيح.