سرعة التفاعل الكيميائي تزداد زيادة تركيز المواد المتفاعلة
- في معظم الحالات تكون سرعة التفاعل الكيميائي دالة لتركيز بعض أو كل المواد المشتركة في التفاعل (مواد متفاعلة وناتجة) ولكن في العادة المواد المتفاعلة فقط.
- الزيادة في تركيز المواد المتفاعلة عموماً تزيد من سرعة التفاعل لأن زيادة تركيز المواد المتفاعلة يؤدى إلى زيادة عدد الدقائق فى وحدة الحجم الذي يؤدي إلى زيادة على التصادمات الكلية المحتملة ومنها أزدياد عدد التصادمات الفعالة وبالتالي زيادة سرعة التفاعل.
زيادة تركيز المواد المتفاعلة ← إزدياد عدد الدقائق فى وحدة الحجم ← ازدياد عدد التصادمات الكلية المحتملة ← أزدياد عدد التصادمات الفعالة ← زيادة سرعة التفاعل.

- يجب أن نضع في الاعتبار أن سرعة أي تفاعل لا تظل ثابتة طوال سير التفاعل ولكنها تكون أعلى ما يمكن فى البداية ثم تقل تدريجياً مع الزمن كلما استهلكت المواد المتفاعلة.
- من الوجهة النظرية تحتاج سرعة التفاعل إلى وقت لا نهائي لكي تصل إلى الصفر. وعملياً فإن السرعة تصبح أقل ما يمكن بعد فترة عندها يصبح من المستحيل قياس سرعة التفاعل.
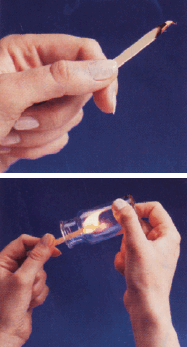
تجربة (1) اثر زيادة تركيز الأكسجين في سرعة التفاعل الكيميائي
- الشكل التالي يوضح أثر زيادة تركيز الأكسجين فى سرعة التفاعل حيث تضئ الشظية المشتعلة فى الهواء والذي يحتوى على غاز الأكسجين بنسبة 20% لكنها تتوهج بشكل لهب عند ادخالها في قنينة مملوءة بغاز الأكسجين والسبب هو زيادة تركيز الأكسجين الذي يؤدى ألى زيادة سرعة الأشتعال (التفاعل)
تجربة (2) :تفاعل حمض الهيدروكلوريك بتراكيز مختلفة مع الماغنسيوم
المواد والأدوات اللازمة
- شريط من الماغنسيوم Mg
- ثلاثة محاليل HCl أحدهما بتركيز 1 مول/لتر والثاني بتركيز 0.1 مول/لتر والثالث /بتركيز 0.01 مول/لتر
- ثلاثة أنابيب أختبار
- حامل أنابيب الأختبار
- قفازات
خطوات التجربة
(1) ضع فى أنبوبة الاختبار الأول 5 مل من حمض HCl الذي تركيزه 1 مول/لتر.
(2) ضع فى أنبوبة الاختبار الثاني 5 مل من حمض HCl الذي تركيزه 0.1 مول/لتر.
(3) ضع فى أنبوبة الاختبار الثالث 5 مل من حمض HCl الذي تركيزه 0.01 مول/لتر.
(4) قص 10 سم من شريط الماغنسيوم وقطعه إلى ثلاث قطع متساوية.
(5) أضف قطعة من الماغنسيوم إلى كل أنبوب من الأنابيب السابقة.
النتائج
(1) يؤدى تفاعل الماغنسوم مع محلول HCl إلى تصاعد غاز الهيدروجين كما فى المعادلة الآتية:
(2) يتضح أن الأنبوب الذي يحتوى على محلول تركيزه 1 مول/لتر كانت كمية غاز الهيدروجين المتصاعدة منه أكبر ما يمكن ويليه الأنبوب الذي يحتوى على محلول HCl ذي التركيز 0.1 وأقلها المحلول ذو التركيز 0.01 مول/لتر وهذا يدل على أن سرعة التفاعل الكيميائي زادت بزيادة تركيز HCl (المواد المتفاعلة)
التفسير العلمي
إن ازدياد تركيز HCl يزيد من عدد أيونات -Cl و +H الموجودة فى وحدة الحجم وهذا بدوره يزيد من عدد التصادمات الكلية المحتملة بينها وبين دقائق الماغنسيوم فيزداد عدد التصادمات الفعالة فيؤدي إلى زيادة سرعة التفاعل.
ويمكن توضيح ذلك من خلال المخطط الآتي:
زيادة تركيز HCl ← إزدياد عدد الدقائق فى وحدة الحجم ← ازدياد عدد التصادمات الكلية المحتملة ← أزدياد عدد التصادمات الفعالة ← زيادة سرعة التفاعل.