قاعدة حساب عدد الأفلاك المهجنة
- يتم استخدام القاعدة التالية مباشرة لحساب عدد الأفلاك المهجنة فى جزئ ما
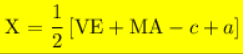
حيث
X = عدد الأفلاك المهجنة
VE = عدد الكترونات التكافؤ للذرة المركزية
MA = العدد الإجمالي للذرات / المجموعات أحادية التكافؤ المحيطة بالذرة المركزية.
C =عدد الشحنات الموجبة على الكاتيون إذا كان النوع المعطى كاتيون متعدد الذرات
a = عدد الشحنات السالبة على الأنيون إذا كان النوع المعطى أنيون متعدد الذرات
ملاحظات هامة :
MA = العدد الإجمالي للذرات / المجموعات أحادية التكافؤ فقط المحيطة بالذرة المركزية حيث تكون MA للذرات ثنائية التكافؤ = صفر
- غالباُ تكون الذرة المركزية هى أقل الذرات الموجودة في السالبية كهربية
التنبؤ بنوع التهجين من قاعدة حساب عدد الافلاك المهجنة
من القاعدة السابقة أذا كان:
X = 2 ← عدد الاوربتالات المهجنة = 2 ← نوع التهجين sp
X = 3 ← عدد الاوربتالات المهجنة = 3 ← نوع التهجين sp2
X = 4 ← عدد الاوربتالات المهجنة = 4 ← نوع التهجين sp3
X = 5 ← عدد الاوربتالات المهجنة = 5 ← نوع التهجين sp3d
X = 6 ← عدد الاوربتالات المهجنة = 6 ← نوع التهجين sp3d2
X = 7 ← عدد الاوربتالات المهجنة = 7 ← نوع التهجين sp3d3
التهجين فى مركب Thionyl fluoride SOF2
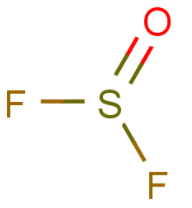
- الذرة المركزية هنا هي ذرة الكبريت لأنها رباعية التكافؤ
VE = 6 لأن عدد الكترونات التكافؤ للكبريت =6
S16 : 1s2 , 2s2 2p6 3s2 3p4
MA = 2 لأن عدد الذرات أحادية التكافؤ هي الفلور وهما ذرتين فقط
c = 0 , a = 0 لأنه لا يوجد فى المركب شحنات موجبة أو شحنات سالبة (أنيون أو كاتيون)
X= ? , MA = 2 , VE = 6 , c = 0 , a = 0
[ X = 1/2 [ 6 + 2 - 0 + 0
X = 4
وبما أن X = 4 فأن:
عدد الأفلاك المهجنة فى مركب SOF2 يساوى(4) أوربتالات مهجنة والتهجين لذرة الكبريت المركزية من النوع sp3
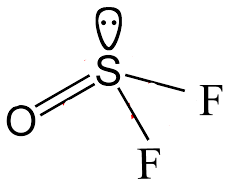
تحديد الشكل الهندسي فس مركب SOF2
- لمعرفة الأشكال الهندسية للمركبات يجب أتباع قاعدة AXnNm
حيث A : الذرة المركزية
X : الذرة المرتبطة بالذرة المركزية (الليجاند).
N : زوج الألكترونات الحر Lone Pair
n , m : هي أعداد حيث (n) : عدد الذرات المرتبطة بالذرة المركزية ، (m): عدد أزواج الألكترونات الحرة.
ثم أستخدم الجدول التالي:
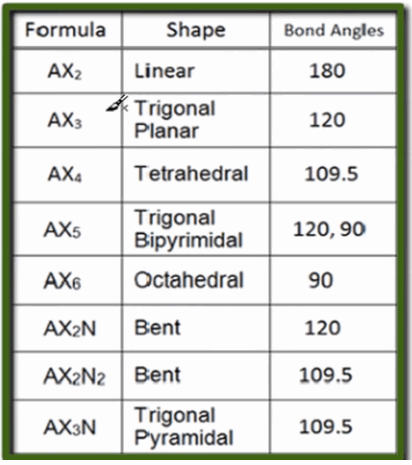
وتطبيق القاعدة السابقة على مركب SOF2 فيكون على الصيغة AX3N وهي الصيغة المقابلة للشكل الهندسي Trigonal Pyramidal