يمكن حساب المولارية من القانون التالي:
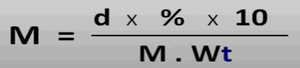
أولاً : حساب مولارية المحلول الأول المعطى
سوف نقوم هنا بحساب مولارية المحلول الاول.
- الوزن الجزيئي لحمض الهيدروكلوريك = 1 + 35.5 = 36.5 جم/مول
- النسبة المئوية الوزنية = 10%
- الكثافة = 1.05 جم /مول
وقم بالتعويض فى القانون أعلاه :
Molarity = 1.05 * 10 * 10 / 36.5
2.88M =
مولارية حمض الهيدروكلوريك الموجود معنا هو 2.88M
ثانياً : حساب مولارية المحلول الثاني المطلوب
- الوزن الجزيئي لحمض الهيدروكلوريك = 1 + 35.5 = 36.5 جم/مول
- النسبة المئوية الوزنية = 3.8%
- الكثافة = 1.02 جم /مول
وقم بالتعويض فى القانون أعلاه :
Molarity = 1.02 * 3.8 * 10 / 36.5
1.062M =
مولارية حمض الهيدروكلوريك المطلوب تحضيره هو 1.062M
الموجود لدينا هو حمض الهيدروكلوريك تركيز 2.88M والمطلوب تحضير محلول منه تركيز 1.062M
والمطلوب تحضير 50 مل HCl تركيز 1.062M من المحلول HCl الذي تركيزه 2.88M لذلك نستخدم قانون التخفيف
ثالثاً : حساب الحجم المطلوب باستخدام قانون التخفيف
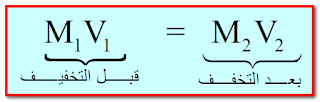
حيث :
M1 : تركيز المحلول الإبتدائي (قبل التخفيف)
M2 : تركيز المحلول النهائي (بعد التخفيف - أي عند إضافة مزيد من المذيب)
V1 : حجم المحلول الإبتدائي (قبل التخفيف - أي قبل إضافة المذيب)
V2 : حجم المحلول النهائي (بعد التخفيف - أي بعد إضافة المذيب)
من المعطيات السابقة
M1 = 2.88 , V1 = ?? ml , M2 = 1.062 , V2 =50ml
وبالتعويض فى القانون نجد أن :
M1 * V1 = M2 * V2
50 * 1.062 = V1 * 2.88
V1 = 18.43 ml
وهو الحجم المطلوب فى السؤال
حجم الماء المضاف = حجم المحلول بعد التخفيف (V2) - حجم المحلول قبل التخفيف (V1)
حجم الماء المضاف = 50 - 18.43 = 31.57 مل
لتحضير 50 مل من HCl تركيزه 1.062M نضيف 18.43 مل من HCl الذي تركيزه 2.88M إلى 31.57 مل من الماء