إذا كان حول الذرة المركزية أربعة مجموعات من الأزواج الإلكترونية
إذا كان حول الذرة المركزية أربعة مجموعات من الأزواج الإلكترونية فأن هناك ثلاث احتمالات للشكل الهندسي الناتج:
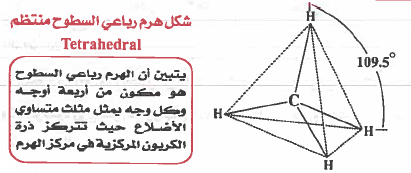
(1) هرم رباعي الأوجه منتظم (هرم رباعي السطوح) Tetrahedral
- هذه المركبات يرمز لها بـ AX4 ( أي أن الذرة المركزية A ترتبط بأربع ذرات فقط 4X)
- وفي هذه الحالة ترتبط الذرة المركزية بأربعة أزواج رابطة فقط .
- وفي هذه الحالة فأن الزاوية بين الروابط (X AX) تكون 109.5°
- ومن الأمثلة على هذا النوع:
-CH4 & CCl4 & NH4+ & SnF4 & PCl4+ & CF4 & SnCl4 & PH4+ & BF4- & CIO4- & PO4³
مثال (1): الميثان CH4
- تركيب لويس للميثان هو:
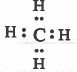
نلاحظ أن حـول الذرة المركزية (C) أربعة أزواج من الإلكترونات الرابطة ، وبذلك تـتـوزع هذه الإلكترونات بحيث تكون أبعد ما يمكن عن بعضها بحيث تقلل من أثر التنافر بينها ، لتصبح في اركان شكل هرمي رباعي السطوح مركزه ذرة الكربون ، وتكون الزاوية ( HCH ) تساوي 109.5⁰
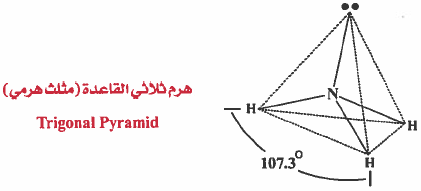
(2) هرم ثلاثي القاعدة (هرم ثلاثي) Trigonal Pyramid :
- هذه المركبات يرمز لها بـ AX3E أي أن الذرة المركزية A ترتبط بثلاث ذرات 3ْX وزوج غير رابط (حر)E.
- حيث A : تمثل الذرة المركزية , X : تمثل الذرة المرتبطة , E: زوج حر (غیر رابط).
- وفي هذه الحالة ترتبط الذرة المركزية بثلاثة ازواج رابطة وزوج حر واحد .
- ومن الأمثلة على هذا النوع:
-NH3 & NF3 & PF3 & PCl3 & AsH3 & ClO3- & H3O+ & SOCI2 & CO32- & CH3
مثال (1) : النشادر (الأمونيا) NH3
- تركيب لويس هو:
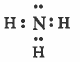
نلاحظ ان حـول الذرة المركزية (N) ثلاثة ازواج رابطة وزوج حـر واحـد ، وبذلك تتوزع هذه الإلكترونات بحيث تكون أبعـد مـا يمكن عن بعضها، بحيث تقلل من أثر التنافر بينها ، لتصبح في أركان شكل هرمي رباعي السطوح مركزه ذرة النيتروجين.
قد يظن المطلع على الشكل السابق أن الشكل الهندسي للنشادر هو هرم رباعي السطوح كما في الميثان CH4 ولكن هذا يعتبر خطأ (علل) لأن الشكل الهندسي للجزيء يحدده أماكن الذرات وليس أماكن الأزواج الإلكترونية ، لذا فإن الشكل الهندسي الصحيح للجزيء هو هرم ثلاثي .
- ويمكن رسم الشكل الهندسي بشكل أوضح كما يلي :
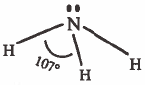
حيث تقع ذرة النيتروجين في قمة هذا الهرم ، وتتركز ذرات الهيدروجين في زوايا قاعدة الهرم المثلثة الشكل ، وتكون الزاوية بين (HNH) تساوي 107o
ملاحظة: نلاحظ وجود زوج حر وهو أكثر حرية (أكثر طاقة) من الزوج الرابط (علل) وذلك لأنه ينجذب إلى نواة ذرة النيتروجين فقط بينمـا الزوج الرابط ينجذب إلى نواتي ذرة الهيدروجين والنيتروجين.
ولهذا فإن التنافر بين الزوج الحر والزوج الرابط أكثر من التنافر بين زوج رابط وزوج رابط أخر ولذلك تتقارب الأزواج الرابطة من بعضها قليلاً لتفادي التنافر مع الزوج الحر وبذلك تصغر الزاوية HNH لتصبح °107 بدلاً من °109.5 كما في الشكل الهندسي للميثان .
(3) زاوي (منحني) Angular أو غير خطي non -Linear أو شكل V - Shaped V :
- هذه المركبات يرمز لها بـ AXE
حيث : A = تمثل الذرة المركزية & X= تمثل الذرة المرتبطة & E=زوج حر (غیر رابط) |
- وفي هذه الحالة ترتبط الذرة المركزية بزوجين رابطين وزوجين غير رابطين .
- ومن الأمثلة على هذا النوع:
-H2O & H2S & CIF2+ & SF2 & SCI2 , OF2 & Cl2O & C1O2- & NH2
مثال (1) : الماء H2O
- تركيب لويس هو:
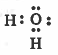
نلاحظ أن حـول الذرة المركزية (O) زوجين رابطين وزوجين غير رابطين ، وبذلك تتوزع هذه الإلكترونات بحيث تكون أبعد ما يمكن عن بعضها بحيث تقلل من أثر التنافر بينها ، لتصبح في أركان شكل هرمي رباعي السطوح مركزه ذرة الأكسجين .
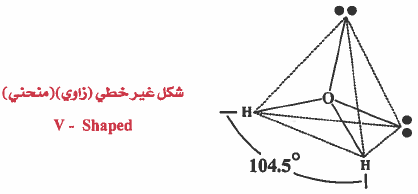
قد يظن المطلع على الشكل السابق أن الشكل الهندسي للماء هو هرم رباعي السطوح كما في الميثان CH4 ولكن هذا يعتبر خطا (علل) لأن الشكل الهندسي للجزيء يحدده أماكن الذرات وليس أماكن الأزواج الإلكترونية ، لذا فإن الشكل الهندسي لجزيء الماء يسمى منحني او زاوي أو شكل V ، . وتكون الزاوية بين (HOH) تساوي °104.5 .
ويمكن رسم الشكل الهندسي بشكل أوضح كما يلي :

ملاحظة: نلاحظ وجود زوجين رابطين وزوجين غير رابطين ، وحيث أن التنافر بين الزوج الحر والزوج الرابط أكثر من التنافر بين زوج رابط وزوج رابط آخر ولذلك تتقارب الروابط من بعضها قليـلاً لـتـفـادي التنافر مع الأزواج الحرة، وبذلك تصـغـر الزاوية HOH لتصبح °104.5 بدلا من °109.5 كما في الشكل الهندسي للميثان .
التنافر بين زوج حر وزوج حر > التنافر بين الزوج الحر والزوج الرابط > التنافر بين زوجين رابطين