التهجين من نوع sp
- ينتج هذا النوع من التهجين من مزج (دمج) مجال من نوع (s) مع مجـال من نوع (p) لنحصل على مـجـالـين من نوع (sp) وتتخذ المجالات المهجنة خطاً مستقيماً في مـسـتـوى واحـد والزاوية بين المجالين °180.
- هذا النوع من التهجين يوجد في الجزيئات أو الأيونات التي حول ذرتها المركزية زوجان أو مجموعتين من الأزواج الإلكترونية.
- ومن الأمثلة على هذا النوع من التهجين : BeCl2 & CO2 & BeH2 & HgCl2& C2H2 & CO2
كيف تتكون الرابطة التساهمية في BeH2 من خلال مفهوم التهجين
(1) نكتب التركيب الإلكتروني لذرة البريليوم في الحالة المستقرة (المنفردة):
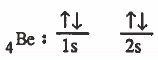
نلاحظ من التوزيع الإلكتروني أن البريليوم لا يحتوي على إلكترونات مفردة ، وهذا يعني ان البـريـليـوم لا يكون أي رابطة تسـاهـمـيـة ، ولكن في الواقع الـبـريـليـوم يرتبط برابطتين تساهميتين (H - Be - H) ولتفسير ذلك يجب الحصول على إلكترونين منفردين كما في الخطوة التالية.
(2) ينتقل (يستثار) إلكترون من المدار (2s) إلى أحد مجالات (2p) الفارغة عندما يكتسب طاقة ليصبح لدينا إلكترونين منفردين.
ويكون التركيب الإلكتروني لذرة البريليوم في الحالة المثارة:
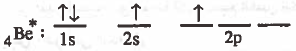
نلاحظ توافر الكترونين منفردين ولكن عندما يرتبط البريليوم مع الهيدروجين يحدث تداخل بين المجالين ( 2s - 1s ) وكذلك بين ( 2p - 1s ) ينتج عن ذلك رابطتين غـيـر مـتكـافـئتين وهذا يناقض مـا هـو مـعـروف من أن رابطتي ( Be - H) مـتـمـاثلتين في القوة والطول، ولتفسير ذلك يجب الحصول على مجالين متماثلين كما يلي:
(3) تحدث عملية دمج بين مـجـال من (p) والمجال (2s) لينتج مجالين مهجنين متساويين في الشكل والطاقة ويرمز لكل منهما (sp).
ويكون التركيب الإلكتروني لذرة البريليوم في بعد التهجين:
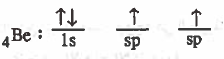
(4) يحدث تداخل بين مـجـال ( 1s ) من ذرة الهيدروجين ومـجـالات (sp) المهجنة من ذرة البريليوم لتتكون رابطتين تساهميتين وهذه الرابطتان متساويتان في الشكل والطاقة ولذلك سوف تكون الزاوية H Be H تكون (°180)
وحيث ان المركب ينتمي إلى النوع (AX2) ، إذن الشكل الهندسي للجزيء هو شكلاً خطياً (Linear) . وهذا الشكل الهندسي هو الشكل الوحيد الذي يجعل الزوجان الإلكترونيان أقل تنافراً.
