مثال (2): كيفية تكون الرابطة التساهمية في NH3 من خلال مفهوم التهجين .
(1) تكتب التركيب الإلكتروني لذرة النيتروجين في الحالة المستقرة:
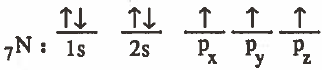
تركيب لويس لجـزئ NH3 هو
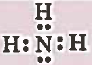
نلاحظ ان حـول الذرة المركزية أربعـة ازواج إلكترونية، فإنه حسب نظرية (VSEPR) سوف تتوزع الأزواج الإلكترونية في أركان هرم رباعي السطوح.
وهذا يعني أن التهجين من نوع sp3
وبذلك فنحن في حاجة إلى أربعة مدارات متساوية في الطاقة، بحيث يكون ثلاثة مدارات منها يحتوي كل منها على إلكترون منفرد.
ملاحظة: في هذه الحالة لن تحتاج إلى نقل إلكترون لأنه متوفر لدينا ثلاثة إلكترونات مفردة.
(2) تحدث عملية دمج بين ثلاث مجالات من (p) والمجال (2s) لينتج أربع مجالات مهجنة متساوية في الشكل والطاقة ويرمز لكل منهما (sp3)
ويحتوى كل منها على إلكترون منفرد فيما عدا مدار واحد يحتوي على زوج إلكتروني غير رابط (حر).
التركيب الإلكتروني لذرة الكربون في بعد التهجين:
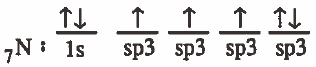
(3) يحدث تداخل بين مجال (1s) من ذرة الهيدروجين وثلاث مجالات من (sp3) المهجن من ذرة النيتروجين لتتكون ثلاث روابط تساهمية.
وهذه الروابط متساوية في الشكل والطاقة أما المدار الرابع فيحتوي على زوج من الإلكترونات الحرة.
وحيث أن الزوج الإلكتروني غير الرابط أكثر طاقة من الزوج الرابط لذا فإنه يشغل حيز أكبر في الفراغ وبالتالي سوف يزداد التنافر بين إلكترونات الزوج الحر وإلكترونات الأزواج الرابطة وبالتالي تقل الزاوية بين أي رابطتين في النشادر عن مـا هـو مـوجـود في الميـثـان (°109.5) لتـصـبح الزاويةHNH حوالي. (107.3o)
وحيث أن المركب ينتمي إلى النوع (AX3E) ، إذن الشكل الهندسي للـجـزيء هو هرم ثلاثي (Trigonal Pyramid)
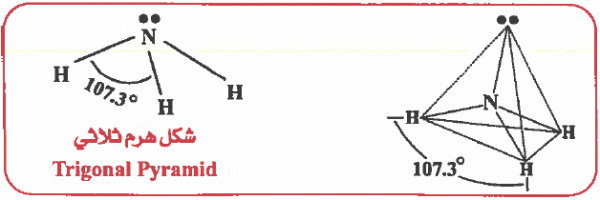
من الأمثلة المشابهة للنشادر NH3 في التهجين والشكل الهندسي:
NF3 & PF3 & PC13 & AsH3
مثال (3) كيفية تكون الرابطة التساهمية في H2O من خلال مفهوم التهجين
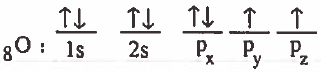
(1) نكتب التركيب الإلكتروني لذرة الأكسجين في الحالة المستقرة:
تركيب لويس لجزيء H2O هو:
نلاحظ أن حول الذرة المركزية أربعة أزواج إلكترونية، فإنه حسب نظرية ( VSEPR ) سوف تتوزع الأزواج الإلكترونية في اركان هرم رباعي السطوح ، وهذا يعني أن التهجين من نوع sp3.
وبذلك فنحن في حـاجـة أربعـة مـدارات مـتـساوية في الطاقة بحيث يكون مدارين منها يحتوي كل منهما على إلكترون منفرد
ملاحظة: في هذه الحالة لن نحتاج لنقل إلكترون لأنه متوفر لدينا إلكترونان مفردان .
(2) تحدث عملية دمج بين ثلاث مجالات من (p) والمجال (2s) لينتج أربع مدارات مهجنة متساوية في الشكل والطاقة ويرمز لكل منهما (sp3) .
ويحتـوى مـداران منها على إلكترون منفرد اما المداران الآخران فيحتوي كل منهما على زوج الكتروني حر .
التركيب الإلكتروني لذرة الأكسجين بعد التهجين:
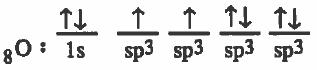
(3) يحدث تداخل بين مجال (1s) من ذرة الهيدروجين ومجالين من (sp3) المهجن من ذرة الأكسجين لتتكون رابطتين تساهميتين.
وهذه الرابطتان متساويتان في الشكل والطاقـة أمـا المدار الثالث والرابع من (sp3) فيحتوي كل منهما على زوج من الإلكترونات الحرة
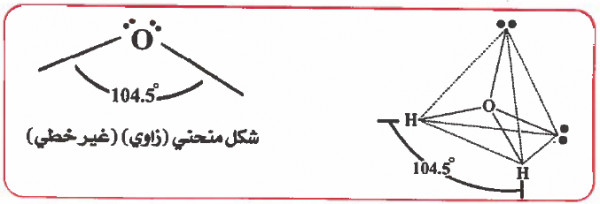
وحيث أن الزوج الإلكتروني غير الرابط أكثر طاقة من الزوج الرابط لذا فإنه يشغل حيز أكبر في الفراغ وبالتـالي سوف يزداد التنـافـر بين إلـكـتـرونـات الأزواج الـحـرة وإلكترونات الأزواج للرابطة وبالتالي تقل الزاوية بين الرابطتين في الماء لتصبح الزاوية HOH تساوي (104.5o) .
وحيث أن المركب ينتمي إلى النوع (AX2E2) ، إذنالشكل الهندسي للجزيء هـو زاوي (منحني) Angular
من الأمثلة المشابهة للماء H2O في التهجين والشكل الهندسي:
OF2 & H2S & ClF2+ & SF2 & SCl2 & OCl2 & ClO2- & NH2- & Cl2O
ملاحظة: إذا رمزنا بالرمز (LP) للزوج الحر ورمـزنـا لـ (BP) للزوج الرابط ، فـإن طاقـات التنافر تترتب كما يلي:
LP-LP > LP - BP > BP - BP