مسائل محلولة على قانون هس
مثال (1): احسب طاقة التفاعل التالي:
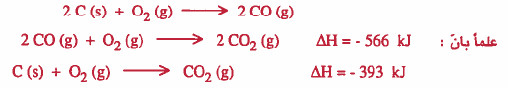
الحل:
نلاحظ ان التفاعل الأول هو حاصل جمع:
معكوس التفاعل الثاني + مضروب التفاعل الثالث في العدد 2
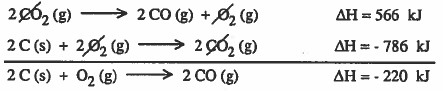
من المعادلة يتبين أن الطاقة الناتجة عن احتراق (2mol C) هو ΔH = - 220 kJ
وإذا كان المطلوب الطاقة الناتجة عن احتراق (1mol C) فإن : ΔH = - 110 kJ
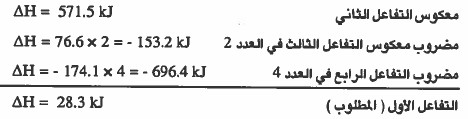
مثال (2): احسب ΔH للتفاعل التالي:
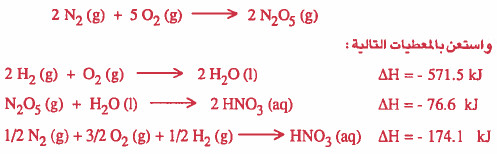
الحل:
نلاحظ أن التفاعل الأول هو حاصل جمع:
معکوس التفاعل الثاني + مضروب معکوس التفاعل الثالث في العدد 2 + مضروب التفاعل االرابع في العدد 4
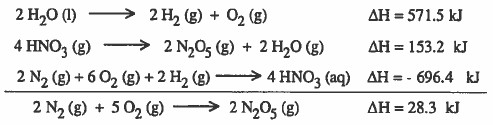
توضيح إضافي لحل السؤال السابق
- قد يبدو أن هناك صعوبة في حل هذا السؤال ، لأنه يـعـتـمـد على التفكير وإجـراء بعض المحاولات لحل السؤال .
- ولتعلم أن هذا النوع من الأسئلة ليس المهم فيه كيفية الوصول للحل ، وإنما المهم هو الحل النهائي ، وبالتالي يمكنك أن تبتكر طريقة خاصة لحل هذه الأسئلة.
طريقة لحل السؤال السابق:
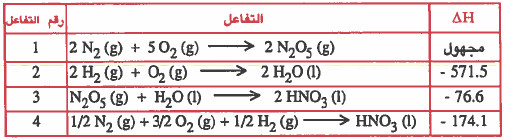
- ننظر في المواد الأساسية في التفاعل المطلوب (التفاعل رقم 1) .
- نلاحظ وجـود المادة (2N2) وهذه المادة مـوجـودة في التفاعل 4 ولكنهـا بشكل مـخـتـلف (1/2N2) ، لذلك يجب تعديل المعادلة (4) بضربها في العدد (4) لتصبح المعادلة كما يلي:
ولا تنسى ان تضرب حرارة التفاعل في العدد (4) أيضاً:

- نلاحظ وجـود المادة (2N2O5) في النواتج وهذه المادة مـوجـودة في الـتـفـاعل 3 ولكنهـا بشكل مـخـتـلف(N2O5) وفي المـتـفـاعـلات وليس النواتج ، لذلك يجب تـعـديل المعادلة (3) بعكسها (أي عكس إشارة التفاعل) وضربها في العدد (2) لتصبح المعادلة كما يلي:
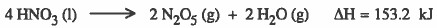
والآن نحاول أن نجمع التفاعلين السابقين وننظر للنتيجة:
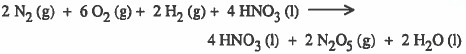
يبدو أنك لاحظت انه لكي نصل للتفاعل 1 من التفاعل السابق يجب حذف مثلاً ( 2H2) و (2H2O) . ولا يتم ذلك إلا بجمع التفاعل السابق مع معكوس التفاعل 2 كما يلي:
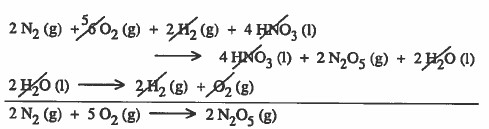
والآن يبدو انك لاحظت أنه للحصول على التفاعل الأول باختصار يجب جمع:
مثال (3) احسب طاقة التفاعل:
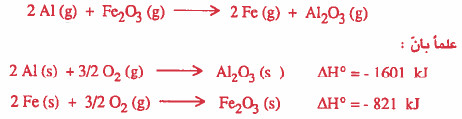
الحل :
نلاحظ انه للحصول على التفاعل الأول يجب جمع: التفاعل الثاني + معكوس التفاعل الثالث.
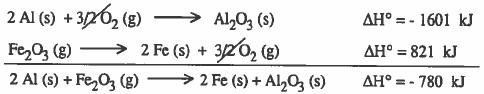
مثال (4): أوجد الحرارة الناتجة عن التفاعل التالي:
الحل : نلاحظ انه للحصول على التفاعل الأول يجب جمع:
مضروب التفاعل الثاني في العدد 2 + التفاعل الثالث + التفاعل الرابع
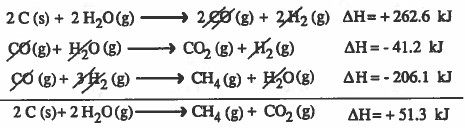
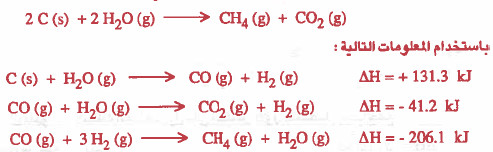
مثال (5): أوجد حرارة تكوين (ΔHf) الإستيلين C2H2 باستخدام المعلومات التالية:
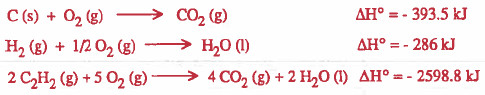
الحل :
لكي نحصل على حرارة تكوين الإستيلين يجب كتابة معادلة تكوين الإستيلين:
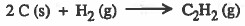
نلاحظ انه للحصول على طاقة هذا التفاعل يجب جمع:
مضروب التفاعل الأول في العدد 2 + التفاعل الثاني + مقسوم معكوس التفاعل الثالث على العدد 2
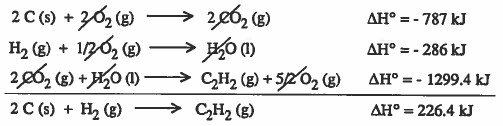
مثال (6) أوجد حرارة تكوين (ΔHf) الإستيلين C2H2 باستخدام المعلومات التالية:
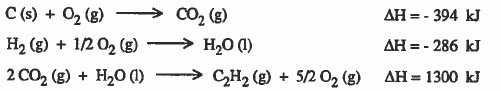
حل مختصر : مضروب التفاعل الأول في العدد 2 + التفاعل الثاني + التفاعل الثالث
ΔH = +226 kJ