الرقم الهيدروجيني pH
- تعريف الرقم الهيدروجيني: هو مقياس أسهل للتعبير عن تركيز ايونات الهيدرونيوم (+H3O).
- القوانين المستخدمة لحساب pH:
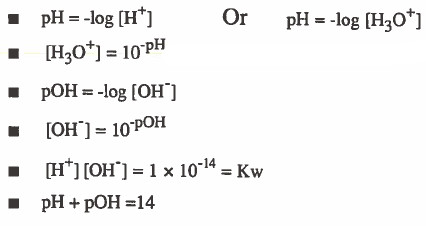
حيث يكون:
pH = الأس الهيدروجيني
pOH = الأس الهيدروكسيدي
[OH] = تركيز أيونات الهيدروکسید
[+H3O] = تركيز أيونات الهيدرونیوم
كيفية التوصل للقانون ( 14 = pH + pOH )
بما أن:
Kw = [H+] [OH-] = 1 × 10-14
بأخذ log للطرفين:
(10-14 log Kw = log [H+] + log [OH-] = log (1 x
بالضرب في (-)
log Kw = (- log [H+] ) + (- log [OH-]) = - log (1 x 10-14) -
pKw = pH + pOH = 14
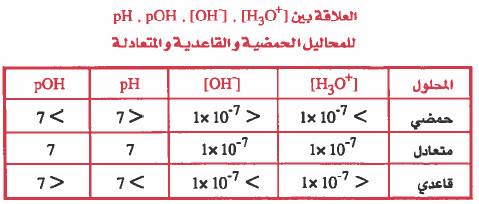
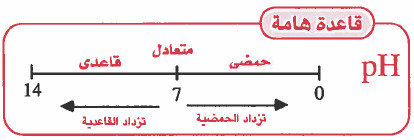
العلاقة بين pH ، POH للمحاليل الحمضية والقاعدية والمتعادلة
مسائل محلولة على pH
مـثـال (1): احسب الأس الهيدروجيني pH ، ثم بين أي المحاليل حـمـضـي وأيهـا قاعدي فيما يلي:
(1) محلول ترکیزه (0.012M ) من (+H3O) .
(2) محلول ترکیزه (0.025M) من (-OH) .
الحل:

مثال (2): أحسب POH للمحاليل التالية:
(1) محلول تركيزه molar 3 × 10-3 من (+H3O) .
(2) محلول ترکیزه (0.0025M) من (-OH) .
الحل:
(1)
pH = -log [H3O+]
pH = - log (3 x 10-3) = 2.52
pH + pOH = 14
pOH = 14 - 2.52 = 11.48
(2)
pOH = - log [OH-]
pOH = - log (0.0025) = 2.6
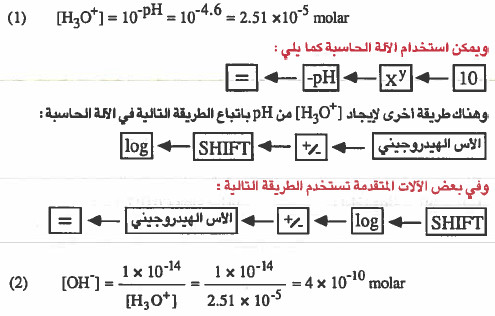
مثال (3): إذا علمت أن الأس (الرقم) الهيدروجيني لمحلول يساوي 4.6 فاحسب:
(1) تركيز أيونات الهيدرونيوم
(2) ترکیز أيونات الهيدروکسید
الحل:
مثال (4): أي المحاليل التالية أعلى حمضية:
(1) PH = 7
(2) pOH = 2
(3) pH = 3
(4) pOH = 9
الحل:
نحول جميع القيم إلى pH:
(1) pH=7
(2 ) pH = 14 - 2 = 12
(3) pH = 3
(4) pH = 14 - 9 = 5
تترتب المحاليل تصاعدياً حسب الزيادة في حمضيتها كما يلي:
(2) < (1) < (4) < (3)
مثال (5): أحسب ثابت تأين الماء ( pKw ) إذا كان تركيز أيونات الهيدروجين (+H) هو 4-10× 2.5 مولار وتركيز أيونات الهيدروکسید (OH-) يساوي 11-10× 4 مولار
الحل:
Kw = [H+] [OH-]
10-14× 1 = ( 10-11× 4 ) * ( 10-4× 2.5 ) =
pKw = - log (Kw)
pKw = - log ( 1 x 10-14 ) = 14