الأملاح المتعادلة Neutral salts
- يسمى ملح من النوع الأول
- هذا الملح ينتج من تفاعل حمض قوي وقاعدة قوية.
- هي أملاح ذات أثر متعادل أي أن: (7 = pH) .
- عندما تذوب في الماء فأنها تتفكك إلى أيونات موجبة وسالبة وهذه الأيونات لا تتميأ أي لا تتفاعل مع الماء.
- الملح المتعادل: هو ملح ناتج عن تفاعل حمض قوي وقاعدة قوية .
مثال توضيحي:
- ملح كلوريد الصوديوم NaCl ملح متعادل لأنه ناتج عن تفاعل حمض الكلور HCl (حمض قوي) وهيدروكسيد الصوديوم NaOH (قاعدة قوية) كما في المعادلة :
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (1)
بالنسبة للمحاليل المتعادلة:
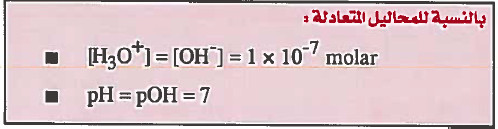
مسألة محلولة على الأملاح المتعادلة
مـثـال (1): احـسـب الأس الهيدروجيني الناتج عن إذابة (0.5mol) من ملح كلوريد الصوديوم في (100mL) من المحلول المائي .
الحل:
سواء كلوريد الصوديوم أو أي ملح متعادل عند إذابته في الماء بأي كمية فإن:
10-7 × 1 = [-OH]= [+H3O]
pH = pOH = 7
توضيح إضافي:
بعض الأحماض القوية:
حمض الكلور (HCl) - حمض النيتريك (HNO3) - حمض الكبريتيك (H2SO4)
بعض القواعد القوية:
هيدروكسيد الصوديوم ( NaOH ) - هيدروكسيد البوتاسيوم ( KOH )
أمثلة على تكوين الاملاح المتعادلة من الحمض القوي والقاعدة القوية :
(1) ملح كلوريد الصوديوم NaCl
HCl + NaOH → NaCl + H2O
(2) ملح كلوريد البوتاسيوم KCl
HCl + KOH → KCl + H2O
(3) ملح نترات البوتاسيوم KNO3
HNO3 + KOH → KNO3 + H2O
(4) ملح نترات الصوديوم NaNO3
HNO3 + NaOH → NaNO3 + H2O
(5) ملح كبريتات الصوديوم Na2SO4
H2SO4 + 2 NaOH → NaSO4 + 2H2O
وجميع هذه الأملاح عندما تذوب في الماء بأي كمية فإن :
10-7 × 1 = [-OH] = [+H3O]
pH = pOH = 7
أسئلة على الأملاح المتعادلة
(1) أي المحاليل التالية المائية التالية تكون له ( 7 = pH ) :
(أ) محلول CH3COONa
(ب) محلول NaCl
(جـ) محلول NH4C1
(د) محلول NH3
(2) عند إذابة 2mol من نترات الصوديوم NaNO3 في 100ML من المحلول فإن قـيـمـة [+H3O] لمحلول نترات الصوديوم يساوي:
(أ) 7-10 × 1
(ب) 20
(جـ) 20-10 × 1
(د) 0.3
(3) عند إذابة 20g من كلوريد الصوديوم في نصف لتر من المحلول فإن قيمة pOH هي:
علماً بأن الأوزان الذرية : 35.5 = Na = 23 & Cl
(أ) 0.68
(ب) 0.16
(جـ) 7
(د) 13.84
(4) وسط محلول من كلوريد البوتاسيوم KCl هو :
(أ) وسط قاعدي
(ب) وسط حمضي
(جـ) وسط متعادل
(د) لا توجد إجابة صحيحة
(5) أياً من محاليل المواد التالية يكون قيمة الـ pH له أعلى:
HCl (0.02 M), CH3COOH (2 M), HCOOH (2 M), NaCl (2 M)
(أ) NaCl
(ب) HCOOH
(جـ) CH3COOH
(د) HCl
الإجابات هي: ب ، أ ، جـ ، جـ ، أ