الحامضية فى الأحماض الكربوكسيلية
(1) تزداد قوة الحمضية بوجود المجاميع الساحبة للإلكترونات لأنها تعمل على زيادة استقرار الأنيون حيث تقلل من تركيز الشحنة السالبة على ذرة الأكسجين في مجموعة الهيدروكسيل مما يجعل ذرة الأكسجين تسحب إلكترونات الرابطة O-H نحوها لتعويض النقص الإلكتروني فيسهل فقد البروتون.
(2) تقل الحمضية بوجود المجاميع الدافعة للإلكترونات حيث تعمل على زيادة تركيز الشحنة السالبة على ذرة الأكسجين في مجموعة الهيدروكسيل فتزداد قوة تجاذبها مع ذرة الهيدروجين.
(3) يوضح الجدول التالي تأثير المجموعات الساحبة والدافعة على الحمضية وذلك من خلال قيم Ka:
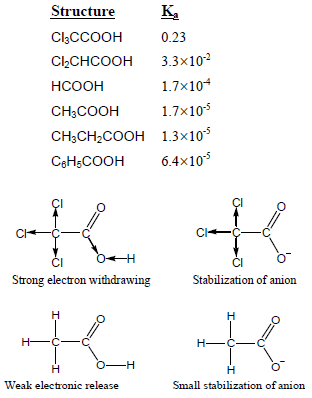
(4) تزداد الحمضية كلما اقتربت المجاميع الساحبة من مجموعة الكربوكسيل .
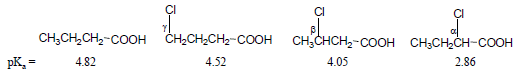
(5) الأحماض الاروماتية أكثر حامضية من الأحماض الأليفاتية نظراً للرنين على الحلقة حيث حلقة البنزين ساحبة للألكترونات عكس مجموعات الألكيل المعطية للألكترونات.
إجابة السؤال
نظراً للأسباب السابقة نجد أن:
(1) حمض الفورميك هو الأعلى بسبب وجود ذرتى أكسجين ذو سالبية الكهربية العالية التى تسهل من خروج هيدروجين الحمض.
(2) يكون حمض البنزويك هو التالي في الحامضية لوجود مجموعة الفينيل phenyl group الساحبة للألكترونات.
(3) يتبقي لدينا مركبين وهما Acrylic acid وحمض الاستيك.
- مجموعة الفينيل vinyl group في حمض الاكريليك و مجموعة الميثيل فى حمض الاستيك كلاهما مجموعات معطية للألكترونات ولكن مجموعة الفينيل vinyl group متصلة مباشرة بمجموعة الكربوكسيل فيحدث الرنين بصورة دائمة Resonance مما يسهل خروج هيدروجيين الحمض.
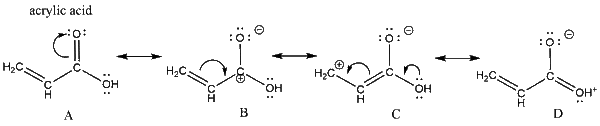
- ويكون الترتيب كالتالي:
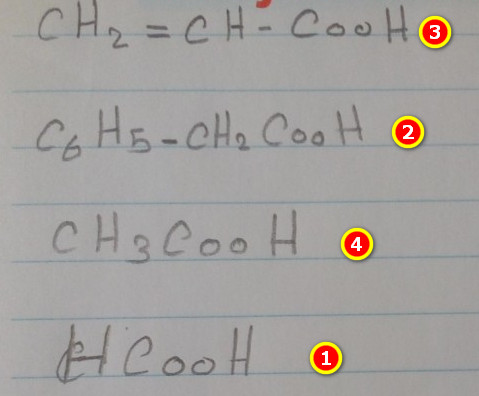
والدليل على ذلك هى قيم pKa كما يلي:
