الحامضية فى الأحماض الكربوكسيلية
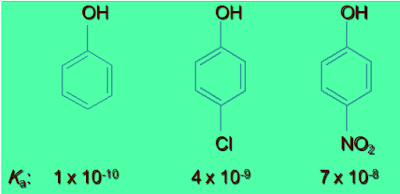
(1) تزداد قوة الحمضية بوجود المجاميع الساحبة للإلكترونات لأنها تعمل على زيادة استقرار الأنيون حيث تقلل من تركيز الشحنة السالبة على ذرة الأكسجين في مجموعة الهيدروكسيل مما يجعل ذرة الأكسجين تسحب إلكترونات الرابطة O-H نحوها لتعويض النقص الإلكتروني فيسهل فقد البروتون.
(2) تقل الحمضية بوجود المجاميع الدافعة للإلكترونات حيث تعمل على زيادة تركيز الشحنة السالبة على ذرة الأكسجين في مجموعة الهيدروكسيل فتزداد قوة تجاذبها مع ذرة الهيدروجين.
(3) يوضح الجدول التالي تأثير المجموعات الساحبة والدافعة على الحمضية وذلك من خلال قيم Ka:
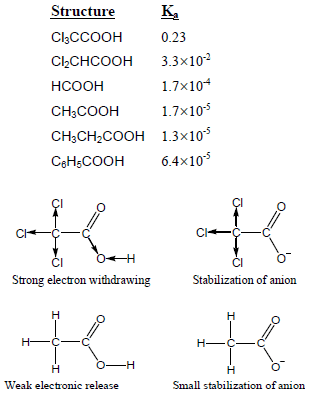
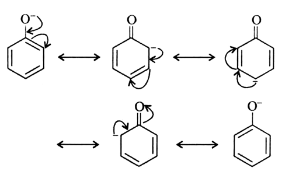
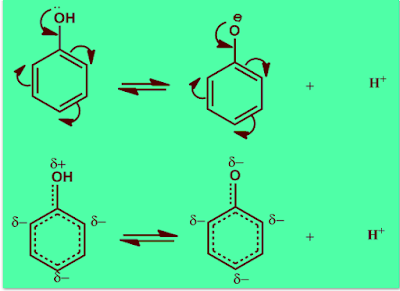
حامضية الفينول
(1) الرنين الموجب يزيد قيمة الشحنة الموجية علي ذرة الاكسجين التي تساعد علي سهولة تأين الفينول الي آيونات هيدروجين موجبة وآيون الفينوكسيد السالب.
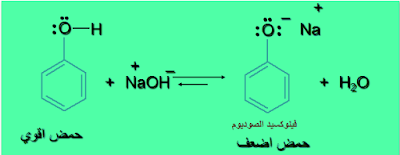
(2) الفينولات تتحول الي آيون الفينوكسيد في الأوساط القاعدية المائية
(3) المجموعة المعطية للالكترونات لها تأثير طفيف أو لا يذكر علي قوة الحموضة
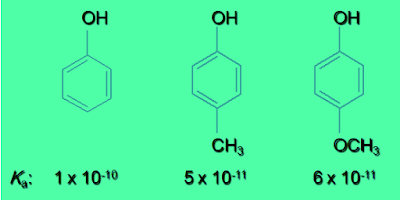
(4) المجموعات الساحبة تزيد الحموضة
أيهما أكثر حامضية الفينول أما حمض البنزويك ؟
حمض البنزويك أعلى حامضية من الفينول
وذلك للأسباب التالية:
(1) وجود مجموعة الفينيل C6H5 الساحبة فى المركبين تعمل على جذب الألكترونات من ذرة الأكسجين فيزداد طول الرابطة بين ذرة الهيدروجين والأكسجين فيسهل خروج ذرة الهيدروجين وتزداد الحامضية.
(2) بالإضافة الى وجود مجموعة الفينيل الساحبة فى حمض البنزويك ولكن وجود ذرتين من الأكسجين في حمض البنزويك (على عكس وجود ذرة أكسجين واحدة فى الفينول) يزود السالبية الكهربية فتعمل ذرات الأكسجين على زيادة سحب الألكترونات ناحية الاكسجين ويزداد طول الرابطة بين الهيدروجين والأكسجين وتبقى ضعيفة سهلة الكسر مما يسهل خروجها أكثر فى حالة حمض البنزويك عنها فى حالة الفينول.
(3) ايون البنزوات اكثر ثباتاً من ايون الفينوكسيد لذلك فأن حمض البنزويك أكثر حامضية من الفينول
(أ) أيون البنزوات مستقر بسبب وجود تركبين متطابقين فقط من التركبيات الرنينية حيث تنتشر الشحنة السالبة على ذرتين أكسجين مجموعة الكربوكسيل فقط.
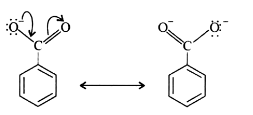
(ب) أيون الفينوكسيد (القاعدة المرافقة للفينول) يمتلك تركيبات رنينية غير متطابقة حيث تنتشر الشحنة السالبة خلال حلقة البنزين .