القانون المستخدم فى معايرة الأحماض والقواعد
- يستخدم القانون التالي فى حسابات معايرة الأحماض والقواعد
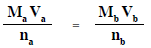
Ma = تركيز الحمض المستخدم (mol/L)
Va = حجم الحمض المستخدم فى المعايرة (ml)
na = عدد المولات من الحمض فى معادلة التفاعل المتزنة
Mb = تركيز القاعدة المستخدم (mol/L)
Vb = حجم القاعدة المستخدم فى المعايرة (ml)
nb = عدد المولات من القاعدة فى معادلة التفاعل المتزنة
حل المسألة:
ما الحجم اللازم من محلول تركيزه 3mol/L من الأمونيا ليتفاعل بالكامل مع 70ml مع حمض الهيدروكلوريك الذي تركيزه 2mol/L؟
الحل:
HCl + NH4OH → NH4Cl + H2O
حمض الهيدروكلوريك HCl يكون:
Ma = 2 mol/L
Va = 70 ml
na = 1
قاعدة هيدروكسيد الأمونيوم (محلول الأمونيا) يكون:
Mb = 3 mol/L
Vb = ?? ml
nb = 1
وبالتعويض فى المعادلة أعلاه يكون:
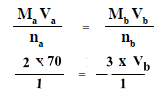
Vb = 46.67 ml
حجم هيدروكسيد الأمونيوم (محلول الأمونيا) المطلوب هو 46.67 مل.