ملحوظة هامة : عدد تأكسد الكبريت فى S2O8-2 هو (+6) وليس (+7) .... فلماذا؟
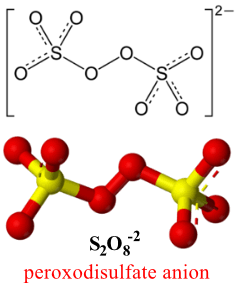
S2O8-2 Peroxodisulfate anion
- بيروكسي ثنائي الكبريتات هو أنيون أكسجيني صيغته 2−S2O8
- يشار إليه أحياناً باسم بيركبريتات (أو بيرسلفات) Persulfate ion.
- من أشهر أمثلة الأملاح الحاوية على هذا الأنيون: بيركبريتات الصوديوم (Na2S2O8) وبيركبريتات البوتاسيوم (K2S2O8) وكذلك بيركبريتات الأمونيوم NH4)2S2O8).
- تكون أملاح البيركبريتات عادة بيضاء اللون وذات انحلالية جيدة في الماء، كما أنها تعد من المؤكسدات القوية.
- الشكل الهندسي لهذا الأنيون يكون كالتالي:
عدد تأكسد الكبريت فى S2O8-2
- عدد تأكسد الكبريت فى S2O8-2 هو +6 وليس +7
- نجد من الشكل الهندسي للأنيون أن ذرات الكبريت ترتبط ببعضها عن طريق الرابطة O-O-) peroxide bond- ) وعليه فأن عدد تأكسد الأكسجين فه هذة الرابطة هو 1- وليس 2- ( كما فى المركب H2O2 يكون تأكسد الأكسجين = -1)
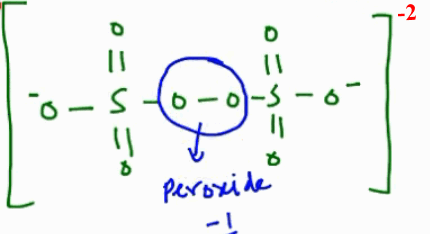
- باقى ذرات الأكسجين وعددهم (6) ذرات عدد التأكسد لهم هو 2-
- يحسب عدد التأكسد للكبريت من العلاقة التالية:
2X + (2*-1) + (6*-2)= -2
2X -2 -12 = -2
2X = +12
X = +6
- عدد تأكسد الكبريت = 6+
- من التوزيع الألكتروني للكبريت 2,8.6 نجد أنه يحتوى على ستة إلكترونات فى المستوى الخارجي. وهذا يؤكد صحة عدد التأكسد هنا.