المحاليل المنظمة Buffer Solutions
- المحاليل المنظمة هي المحاليل التى تقاوم التغير فى الرقم الهيدروجيني pH عند إضافة كميات قليلة من حمض قوي أو قاعدية قوية أو عند التخفيف.
- المحاليل المنظمة تتغير قيمة الرقم الهيدوجيني لها تغيراً طفيفاً عند إضافة حمض أو قاعدة إليها بكميات قليلة، أى أنها تقاوم التغيرات فى قيمة pH لها عند إضافة حمض او قاعدة إليها.
أهمية المحلول المنظم
(1) تتطلب الكثير من العمليات الكيمائية والحيوية أن لا تتغير بل تبقى قريبة من قيمة قيمة الـ pH لوسط التفاعل كثيرا معينة. ومثال على ذلك:
(أ) أن الدم في جسم الإنسان لا يمكن أن يقوم بوظيفة نقل الأوكسجين إلى الخلايا إلا أن تكون قيمة 4.7 = pH.
(ب) الأنزيمات تحتاج لوسط تكون فيه قيمة الـ pH ثابتة تقريبا لتعمل بنشاط, فإذا تغيرت الـ pH للمحلول فإن هذه الإنزيمات ستفقد أو سيتغير شكلها و ربما تفقد وظيفتها الحيوية.
(2) معالجة التربة لنمو المحاصيل المختلفة.
(3) معايرة جهاز قياس الأس الهيدروجينى
مم تتكون المحاليل المنظمة
تتكون المحاليل المنظمة كالتالي:

أنواع المحاليل المنظمة
(أ) المحلول المنظم الحمضي.
- يتكون من: حمض ضعيف (الحمض المرافق) + ملح الحمض الضعيف (القاعدة المرافقة).
- pH < 7
- يفضل استخدام هذة المحاليل المنظمة في الأوساط الحمضية.
- أمثلة:
-CH3COOH , CH3COO
HCN , NaCN
HNO2 , KNO2
(2) المحلول المنظم القاعدي
- يتكون من قاعدة ضعيفة (القاعدة المرافقة) + ملح القاعدة الضعيفة (الحمض المرافق).
- pH >7
- يفضل استخدام هذه المحاليل المنظمة في الأوساط القاعدية.
- أمثلة: الأمونيا وكلوريد الأمونيوم NH3 , NH4Cl
قوانين pH للمحاليل المنظمة
(1) إذا كان الحمض ضعيف وملحه:
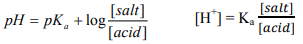
(2) إذا كان القاعدة ضعيفة وملحها:
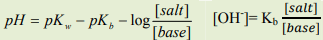
أمثلة على المحاليل المنظمة
- الجدول التالي يعطي بعض الأمثلة على المحاليل المنظمة:
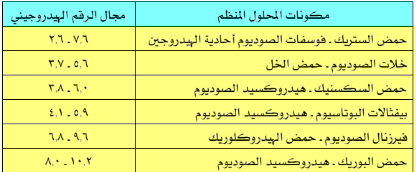
- تستعمل هذة المحاليل مثلاً أثناء تعيير قياس الرقم الهيدروجينى pH-meter أو لتثبيت الرقم الهيدروجيني في معايرات التحليل الحجمي أو فى التحليل الوزني.
- يمكن شراء المحاليل المنظمة ذات رقم هيدروجيني معين أو تحضيرها في المختبر (انظر طريقة تحضير المحاليل المنظمة)
كيف يعمل المحلول المنظم؟
دراسة أثر إضافة حمض HCl إلى المحلول المنظم:
(1) إضافة HCl يعني إضافة +H وبالتالي زيادة تركيز +H3O في المحلول فيختل الاتزان .
(2) وفقاً لمبدأ لوتشاتلييه سينزاح التفاعل (1) نحو اليسار بتفاعل +H3O الزائدة مع -CH3COO .
(3) نتيجة انزياح التفاعل (1) نحو اليسار سيزول تقريباً أثر الزيادة في تركيز +H3O الناتجة من إضافة الحمض HCl وبالتالي تبقى قيمة pH للمحلول ثابتة تقريباً .
دراسة أثر إضافة قاعدة NaOH إلى المحلول المنظم
1- إضافة قاعدة NaOH يعني إضافة OH- والتي تتفاعل مع +H3O في المحلول فيختل الاتزان .
2- وفقاً لمبدأ لوتشاتلييه سينزاح التفاعل (1) نحو اليمين بتفكك المزيد من CH3COOH فيتم تعويض النقص في +H3O فيبقى تركيزها ثابتاً تقريباً ، وبالتالي تبقى قيمة pH للمحلول ثابتة تقريباً .