المحاليل المنظمة Buffer solutions
- هي المحاليل التي تقاوم التغير في الرقم الهيدروجيني للمحلول عند إضافة حامض أو قاعدة للمحلول أو عند تخفيفه.
- يتكون المحلول المنظم من حامض ضعيف وملح هذا الحامض أى القاعدة المرافقة للحامض أو يتكون من قاعدة ضعيفة وملحها أى الحامض المرافق لها .
آلية عمل المحاليل المنظمة
أولاً/ آلية عمل المحاليل المنظمة الحامضية
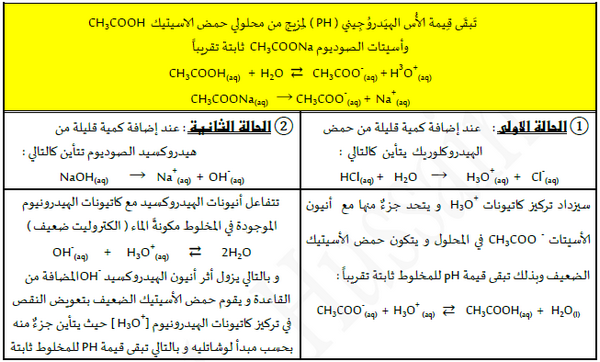
ثانياً / آلية عمل المحاليل المنظمة القاعدية
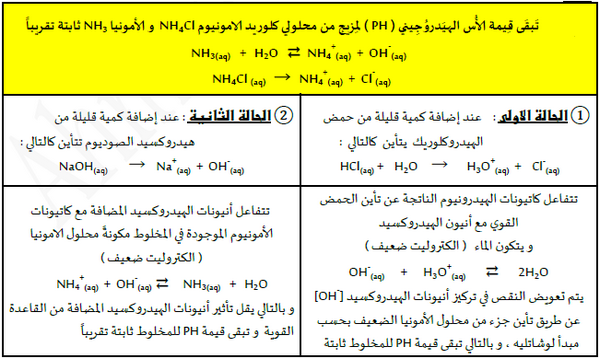
المحلول المنظم المكون من قاعدة ضعيفة وأحد أملاحها
- من المحاليل المنظمة التي تتكون من قاعدة ضعيفة وأحد أملاح محلول هيدروكسيد الأمونيوم وكلوريد الأمونيوم.
- يتأين كلوريد الأمونيوم تأيناً كاملاً عند إذابته في الماء وفق المعادلة التالية:
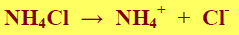
- يتأين هيدروكسيد الأمونيوم جزئيَا في الماء وفق المعادلة التالية :

وبتطبيق قانون فعل الكتلة على الاتزان السابق :
[Kb = [NH4+][OH–] / [NH4OH
(OH–] = Kb [NH4OH] / [NH4+] (1]
وحيث أنه يمكن اعتبار تركيز أيون الأمونيوم في المحلول = تركيز ملح كلوريد الصوديوم وذلك للصغر لتركيز أيونات الأمونيوم الناتجة عن تأين هيدروكسيد الأمونيوم أي أن :
(NH4+] = [NH4Cl] = [salt] (2]
كما يمكن اعتبار أن تركيز هيدروكسيد الأمونيوم في المحلول مساوياً للتركيز الشكلي له وذلك لصغر الكمية المتأينة منه نسبياَ أي أن :
(NH4OH] = [base] (3]
وبالتعويض بالمعادلة (2) ، (3) في المعادلة (1) نحصل على المعادلة التالية :
[+OH–] = Kb [NH4OH] / [NH4]
[OH–] = Kb [base] / [salt]
وبأخذ اللوغاريتم السالب للطرفين :
[log [OH–] = – log Kb – log [base] / [salt
[pOH = pKa – log [base] / [salt
[pOH = pKa + log [salt] / [base
وحيث أن :
pH = pKw – pOH
فيكون :
[pH = pKw – pKb – log [salt]/[base
وهذه العلاقة ذات أهمية بالغة في حساب الرقم الهيدروجيني للمحاليل المنظمة المكونة من قاعدة ضعيفة وأحد أملاحها.