تحضير المحاليل المنظمة
الأساس النظري
- المحلول المنظم هو محلول يتميز بمقاومته للتغيرات في الرقم الهيدروجينى الناتجة عن إضافة كميات صغيرة من حمض أو قاعدة ولا يتغير الرقم الهيدروجيني بالتخفيف.
- يتكون المحلول المنظم من خليط من حمض ضعيف وأحد أملاحه أو قاعدة ضعيفة أو قاعدة ضعيفة وأحد أملاحه أو قاعدة ضعيفة وأحد أملاحها
- الجدول التالي يعطي بعض الأمثلة على المحاليل المنظمة:
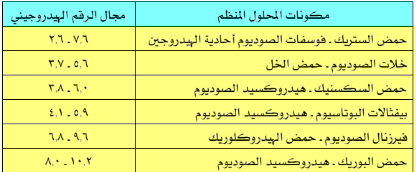
- تستعمل هذة المحاليل مثلاً أثناء تعيير قياس الرقم الهيدروجينى pH-meter أو لتثبيت الرقم الهيدروجيني في معايرات التحليل الحجمي أو فى التحليل الوزني.
- يمكن شراء المحاليل المنظمة ذات رقم هيدروجيني معين أو تحضيرها في المختبر.
طرق تحضير المحاليل المنظمة
لتحضير محلول منظم نتبع الخطوات التالية
(1) اختر المركب المناسب بحيث تكون قيمة pKa قريبة من قيمة pH المرغوب فيه.
(2) حدد التركيز والحجم الذي ترغب به.
- هناك طرق عديدة لتحضير المحاليل المنظمة ومنها:
(1) تحضير المحاليل المنظمة مستخدماً معلومات متوفرة في المراجع.
(2) حساب كمية المواد المكونة للمحلول المنظم وإذابتها في الحجم المناسب من ماء مقطر ثم التأكد من قيم الرقم الهيدروجينى مستخدماً جهاز القياس.
الحسابات
- يحسب pH للمحلول المنظم من معادلات Henderson-Hasselbalch:
أولاً: في حالة تحضير المحلول المنظم من حمض ضعيف وأحد أملاحه نستعمل المعادلة التالية:
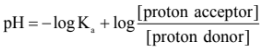
علماً بأن:
Ka : ثابت تفكك الحمض
proton donor : المادة المانحة للبروتون
Proton acceptor : المادة التى يتحد معها البروتون.
- حسب نظرية Lowry , Bronsted الحمض هي المادة المانحة للبروتون والقاعدة هي المادة التى تستقبل هذا البروتون.
Acid → H+ + base
ثانياً: في حالة تحضير المحلول المنظم من قاعدة ضعيفة وأحد أملاحها نستعمل المعادلة التالية:
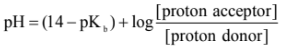
علماً بأن pKb = - log Kb
مثال: احسب pH لمحلول منظم حضر بإضافة 10 مل من حمض الخليك CH3COOH تركيزه 0.1M إلى 20 مل من خلات الصوديوم CH3COONa تركيزه 0.1M وثابت التفكك لحمض الخليك Ka = 1.75 X 10-5
الحل:
أولاً/ نحسب تركيز كل من الحمض وملحه بعد مزج هذة المحاليل (في الحجم الكلي).
عدد ملمولات حمض الخليك = 0.1 × 10 = 1 مليمول
عدد ملمولات أيون الخلات -CH3COO يساوي = 0.1 × 20 = 2 مليمول
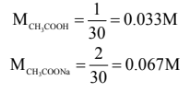
ثانياً/ نحسب pH
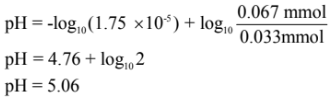
تحضير محلول منظم pH = 9
- من الجدول السابق نجد أن المحاليل المنظمة المكونة من حمض البوريك وهيدروكسيد الصوديوم (Boric buffer solution) تعطى مدي الرقم الهيدروجينى من pH = 8 إلى pH = 10.2
- لتحضير محلول منظم البورات يكون الرقم الهيدروجينى له pH =9 نتبع الخطوات التالية:
(1) أحضر كأس به 500 مل ماء مقطر
(2) أذب 6.20 جم من حمض البوريك فى الماء المقطر .
(3) قم بإضافة هيدروكسيد الصوديوم تركيز 4M تدريجياُ حتى تحصل على الرقم الهيدروجينى (9 = pH) وسنجد تقريباُ أن كمية هيدروكسيد الصوديوم المضافة تساوي 41.5 مل تقريباً.
(4) أكمل المحلول بواسطة الماء المقطر إلى 1000 مل.
المحلول الناتج يسمى كالتالي:
Boric acid buffer solution 0.1M , pH = 9
حسابات للتأكد من صحة الكميات السابقة
- الوزن الجزيئي لحمض البوريك = 61.8 جم/مول لذا فأن الكمية 6.2 جم تعنى 0.1 مول.
- تركيز حمض البوريك = عدد المولات * الحجم باللتر = 0.1 * 1 = 0.1 M
- التركيز الجديد لهيدروكسيد الصوديوم بعد المزج = 4 * 41.5/1000 مل = 0.166 M
- حساب pH من القانون السابق:
علماُ بأن pka لحمض البوريك = 9.24
pH = 9.24 + log(0.166/0.1)
pH = 9.24 - 0.22
pH = 9 تقريباً