تحليل المسألة
- بما أن لديك كتلتي المادتين المتفاعلتين لذا يمكنك تعرّف المادة المحددة للتفاعل، ثم حساب كتلة الناتج.
- ويمكن معرفة عدد مولات المادة الفائضة بناءً على معرفة مولات المادة المحددة للتفاعل، وحساب عدد مولات المادة الفائضة التي تفاعلت وتحويلها إلى كتلة، ثم طرح هذه الكتلة من الكتلة المتوافرة قبل بدء التفاعل.
المعلوم والمطلوب
المعلوم: كتلة الفوسفور = 25g ، كتلة الأكسجين = 50g
المطلوب: كتلة P4O10 عاشر أكسيد رابع الفوسفور = ؟ ، كتلة المادة الفائضة = ؟
حساب المطلوب
أولاً: حساب كتلة P4O10 الناتجة
(1) نكتب المعادلة الموزونة ونحدد المعطيات والمطلوب:
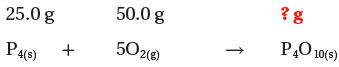
(2) نحسب عدد مولات المواد المتفاعلة
(أ) حساب عدد مولات P4
(الكتلة المولية لرباعى الفوسفور) 1mol → 123g
(الكتلة المستخدمة فى التفاعل) mol → 25g ??
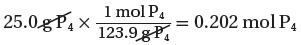
(ب) نحسب عدد مولات O2
(الكتلة المولية لغاز الأكسجين) 1mol → 32g
(الكتلة المستخدمة فى التفاعل) mol → 50g ??
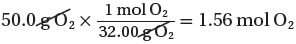
(3) احسب النسب المولية الفعلية لمولات O2 , P4
- احسب نسبة مولات O2 إلى P4
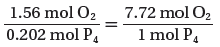
(4) حدد النسبة المولية للمواد المتفاعلة من المعادلة الموزونة:
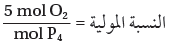
وبما أنه يتوافر 7.72mol من الأكسجين ، في حين أن التفاعل يحتاج فقط 5mol من الأكسجين لتتفاعل مع 1mol من الفوسفور لتكوين 1mol من P4O10 فالأكسجين هو المادة الفائضة ويكون P4 هو المادة المحددة للتفاعل. لذا تستعمل مولات P4 لحساب مولات P4O10 الناتجة.
(5) احسب مولات P4O10 الناتجة من التفاعل
وذلك بضرب عدد مولات P4 في النسبة المولية P4O10/P4
1mol P4 → 1 mol P4O10
0.202mol P4 → ?? mol P4O10
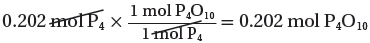
(6) حساب كتلة P4O10
(الكتلة المولية للمركب) 1mol → 283.9g
(الكتلة الناتجة من التفاعل) 0.202mol → ??g
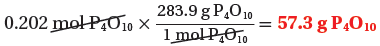
ثانياً: حساب كتلة المادة الفائضة
- بما أن O2 هو المادة الفائضة فإن جزءاً منه فقط يتفاعل. لذا استخدام المادة المحددة للتفاعل P4 لحساب عدد مولات O2 الداخل في التفاعل وكتلته.
1mol P4 → 5 mol O2
0.202mol P4 → ?? mol O2
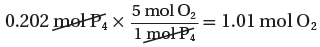
تحويل مولات الأكسجين الداخلة فى التفاعل إلى كتلة
1mol O2 → 32g
1.01mol O2 → ??g
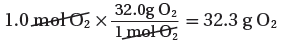
حساب كمية O2 الفائضة
الكمية الفائضة = كتلة المادة - الكمية التى تفاعلت
32.3g O2 - 50g O2 = 17.7g O2