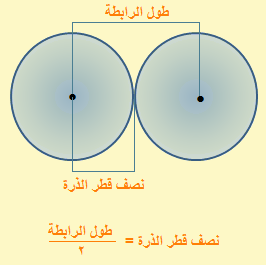
نصف القطــر التساهمــى
في حالــة ذرتيـن متماثلتيـن
نصف القطر التساهمي = نصف المسافة بين نواتى ذرتين متماثلتين ومتحدتين
في حالــة ذرتيـن غيـر متماثلتيــن
نصف قطر أحدي الذرات = طول الرابطة بين ذرتين غير متماثلتين - نصف قطر الذرة الأخرى.
أى أن:
طول الرابطة = نصف قطر أحدى الذرات + نصف قطر الذرة الأخرى.
تدرج نصف قطر الذرة عبر الدورة
- يزيد نصف القطر الذرى في المجموعة الواحدة بزيادة العدد الذرى بالانتقال من أعلى إلى أسفل لأنه بالانتقال من أعلى لأسفل عبر المجموعة الواحدة . يزيد العدد الذرى وتزيد الشحنة الموجبة . ولكن في نفس الوقت تزيد عدد مستويات الطاقة المملوءة بالإلكترونات فتحجب قوة جذب النواة للإلكترونات في المستويات الخارجية . فبذلك تقل قوة جذب النواة لهذه الإلكترونات . فيزيد حجم الذرة ويزيد نصف القطر .
- نظراً لأن الفلور - الكلور - البروم فى مجموعة واحدة وهى مجموعات الهالوجينات
أي أن:
نصف قطر ذرة الفلور < نصف قطر ذرة الكلور < نصف قطر البروم
وبما أن ذرة الهيدروجين تحتوى على الكترون واحد ومستوى واحد فيكون :
نصف قطر ذرة الهيدروجين < نصف قطر ذرة الفلور < نصف قطر ذرة الكلور < نصف قطر البروم
والدليل على ذلك هو:
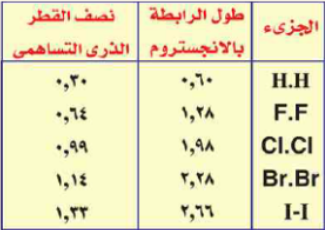
وبما أن :
طول الرابطة = نصف قطر أحدى الذرات + نصف قطر الذرة الأخرى.
، نصف قطر ذرة الهيدروجين < نصف قطر ذرة الفلور < نصف قطر ذرة الكلور < نصف قطر البروم
فيكون :
طول الرابطة كالتالي:
H2 < HF < HCl < HBr
فالأقصر فى جزئ الهيدروجين والأطول فى حمض الهيدروبروميك